
Electronegativitatea la scară Pauling și diferența de energie

Scală Pauling este o scară arbitrară utilizată în chimie pentru a exprima electronegativitate a elementelor. Aceasta este definită ca tendința unui anumit atom de a atrage electroni atunci când este combinată cu un alt atom.
În acest sens, elementele cu electronegativitate ridicată tind să câștige cu ușurință electroni. Acestea sunt nemetalele, în timp ce, la rândul lor, elemente mai puțin electronegative, cum ar fi metalele, este mai ușor să renunțați la electroni.
Prin urmare, cunoscând electronegativitatea unui element, cineva are o idee despre tipul de legătură pe care este capabil să o formeze atunci când este combinat cu altul. Vom vedea acest lucru cu un exemplu numeric mai târziu..
Cu aceste informații, multe dintre proprietățile pe care le va avea un compus pot fi prezise, ceea ce este foarte util în chimia experimentală și în știința materialelor, unde se creează continuu compuși noi..
Cu toate acestea, este convenabil să clarificăm că, în ciuda importanței sale, nu există o singură modalitate de a determina electronegativitatea; Scara Pauling este doar una dintre diferitele moduri propuse pentru a o găsi, deși este una dintre cele mai utilizate.
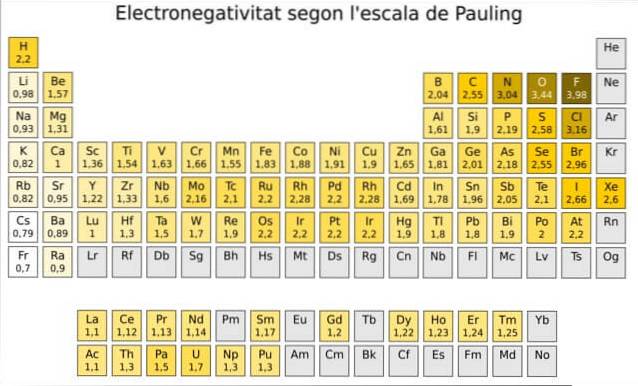
De fapt, Pauling este o scară arbitrară în care o valoare numerică este atribuită fiecărui element din tabelul periodic, care reflectă electronegativitatea acestuia. O vedem în figura 1, unde avem electronegativitatea fiecărui element, așa cum i-a fost atribuit de către dublu premiul Nobel Linus Pauling (1901-1994) în jurul anului 1939.
Indice articol
- 1 Electronegativitatea elementelor
- 1.1 Electronegativitatea în tabelul periodic
- 2 Diferența de energie obligatorie
- 2.1 Ecuații pentru electronegativitate
- 3 Exemplu
- 3.1 Soluție
- 4 Referințe
Electronegativitatea elementelor
Pauling, împreună cu Don M. Yost, au găsit valorile electronegativității în mod empiric, prin date experimentale obținute prin măsurarea energiilor de legătură..
Pauling a atribuit elementului fluor - deasupra și în dreapta tabelului din Figura 1 - cea mai mare electronegativitate, cu numărul 4.0. Deci, atunci când fluorul formează legături, acesta prezintă cea mai mare tendință de a atrage electroni din toate elementele..
Al doilea este oxigenul cu 3,5 și al treilea este azotul cu 3,0. Ambele sunt situate în partea de sus și în dreapta mesei.
Pe de altă parte, la extrema opusă, cel mai puțin electronegativ element este cesiul, al cărui simbol este Cs, situat în stânga tabelului, căruia Pauling i-a atribuit numărul 0,7.
Electronegativitatea în tabelul periodic
În linii generale și așa cum se poate vedea în figura 1, electronegativitatea - și energia de ionizare - crește de la stânga la dreapta în tabelul periodic. Tendința generală indică, de asemenea, o scădere atunci când se deplasează de sus în jos.
Prin urmare, vom avea cele mai electronegative elemente în colțul din dreapta sus al tabelului: fluor, oxigen, clor, azot. Cel mai puțin electronegativ -sau cel mai electropozitiv dacă preferați- se va găsi în stânga: litiu, sodiu, potasiu și celelalte elemente din grupa 1 -coloana din extrema stângă, corespunzătoare metalelor alcaline și alcalino-pământoase.-.
În fiecare coloană, electronegativitatea scade odată cu creșterea numărului atomic al elementului, cu excepția metalelor de tranziție din centru, care nu urmează această tendință..
Un punct important de remarcat este că electronegativitatea este relativă, nu este o proprietate invariabilă a fiecărui element și se măsoară numai în raport cu cea a altor elemente. Depinde foarte mult de starea de oxidare, deci același element poate prezenta o electronegativitate diferită, în funcție de tipul de compus pe care îl formează..
Diferență de energie obligatorie

În chimie, o legătură este modul în care atomii, identici sau diferiți, se unesc pentru a forma molecule. Între atomi apar forțe care îi țin împreună într-un mod stabil.
Există mai multe tipuri de legături, dar aici sunt luate în considerare două:
-Covalent, în care atomii de electronegativități similare împart o pereche de electroni.
-Ionic, frecvent între atomi cu diferite electronegativități în care predomină atracția electrostatică.
Să presupunem că două elemente A și B pot forma molecule între ele, notate AA și BB. Și că sunt, de asemenea, capabili să se unească pentru a forma un compus AB, printr-un anumit tip de legătură.
Datorită participării forțelor intermoleculare, există energie în legătură. De exemplu, energia din legătura AA este EAA, în legătura BB este EBB și în cele din urmă în compusul AB este EAB.
Dacă molecula AB s-a format dintr-o legătură covalentă, teoretic energia de legare este media energiilor EAA și EBB:
ȘIAB = ½ (EAA + ȘIBB)
Pauling a calculat EAB pentru diferiți compuși, el l-a măsurat experimental și a determinat diferența dintre ambele valori, pe care le-a numit Δ:
Δ = | (EAB) măsurat - (EAB) teoretic | = | (EAB) măsurat - ½ (EAA + ȘIBB) |
Pauling a argumentat astfel: dacă Δ este foarte aproape de 0, înseamnă că electronegativitățile ambelor elemente sunt similare și legătura care le unește este covalentă. Dar dacă Δ nu este mic, atunci legătura dintre A și B nu este pură covalentă.
Cu cât valoarea absolută a lui Δ este mai mare, cu atât diferența dintre electronegativitatea elementelor A și B este mai mare și, prin urmare, legătura care le unește va fi de tip ionic. Mai târziu, cititorul va găsi un exemplu în care, calculând Δ, este posibil să se determine tipul de legătură a unui compus.
Ecuații pentru Electronegativitate
Presupunând că diferența de energii este semnalul care distinge natura legăturii, Pauling a efectuat numeroase experimente care l-au determinat să creeze o expresie empirică pentru electronegativitățile relative ale a două elemente A și B care formează o moleculă..
Notând această electronegativitate ca χ (litera greacă „chi”), Pauling a definit Δ după cum urmează:
FDouă· Δ = [χ (A) - χ (B)]Două
χ (A) - χ (B) = f√Δ = 0,102√Δ
Rețineți că Δ este o cantitate pozitivă. Factorul f = 0,102 care apare prin înmulțirea rădăcinii pătrate a lui Δ este factorul de conversie între kJ (kilojoule) și eV (electron-volt), ambele unități de energie.
Dacă în schimb se utilizează kilocalorii și electron-volți, diferența de electronegativități se exprimă cu o formulă similară, dar cu f = 0,208:
χ (A) - χ (B) = 0,208√Δ
Pauling a început prin atribuirea hidrogenului la o valoare de 2,1, o valoare anterioară obținută de chimistul Robert Mulliken. El a ales acest element ca punct de plecare pentru că formează legături covalente cu mulți alții..
Folosind ecuația de mai sus, el a continuat să atribuie valori relative restului elementelor. El a realizat astfel că electronegativitatea crește atunci când se deplasează de la stânga la dreapta și de sus în jos în tabelul periodic, așa cum este descris în secțiunea anterioară..
Exemplu
Mai jos este o listă de elemente: N, J, Y și M și electronegativitățile lor respective Χ conform scalei Pauling:
-N: Χ = 4,0
-J: Χ = 1,5
-Da: Χ = 0,9
-M: Χ = 1.6
Printre următorii compuși formați cu ei:
YJ, YN, MN și JM
Indicați-l pe cel cu cel mai înalt caracter ionic și pe cel a cărui natură este covalentă. Motivul răspunsului dvs..
Soluţie
Conform criteriilor stabilite de Pauling, compusul cu cel mai mare caracter ionic va fi cel cu cea mai mare diferență între electronegativități și, prin urmare, o valoare mai mare de Δ. La rândul său, compusul cu cea mai mică diferență de energie este cel cu o legătură covalentă.
Apoi vom calcula cât valorează Δ pentru fiecare compus, după cum urmează:
YJ compozit
Δ = [χ (Y) - χ (J)]Două = (0,9 - 1,5)Două = 0,36
YN compozit
Δ = [χ (Y) - χ (N)]Două = (0,9 - 4,0)Două = 9,61
MN compozit
Δ = [χ (M) - χ (N)]Două = (1,6 - 4,0)Două = 5,76
JM compozit
Δ = [χ (J) - χ (M)]Două = (1,5 - 1,6)Două = 0,01
Din rezultatele anterioare, rezultă că compusul ionic este YN, al cărui Δ = 9,61, în timp ce compusul covalent este JM, cu Δ = 0,01.
Referințe
- Libretexturi de chimie. Electronegativitate Pauling. Recuperat de pe: chem.libretexts.org.
- Cartea de aur IUPAC. Electronegativitate. Recuperat de pe: goldbook.iupac.org.
- Salas-Banuet, G. Electronegativitatea neînțeleasă. Recuperat de pe: scielo.org.
- Textele științifice. Electronegativitate. Recuperat de pe: textscientificos.com.
- Whitten, K. 2010. Chimie. 9. Ed. Brooks / Cole. Cengage Learning.
- Wikipedia. Legătură covalentă. Recuperat de pe: es.wikipedia.org.
- Wikipedia. Legătură ionică. Recuperat de pe: es.wikipedia.org.



Nimeni nu a comentat acest articol încă.