
Mecanismul, funcția și exemplele de transaminare
transaminare este un tip de reacție chimică care funcționează în „redistribuirea” grupărilor amino dintre aminoacizi, deoarece implică procese reversibile de aminare (adăugarea unei grupe amino) și dezaminare (eliminarea unei grupări amino), care sunt catalizate de enzime specifice cunoscute ca transaminaze sau aminotransferaze.
Reacția generală de transaminare implică schimbul între un aminoacid și orice α-ceto acid, unde schimbul unei grupări amino dă versiunea cetoacidă a primului aminoacid substrat și versiunea aminoacidă a primului substrat α-cetoacid..

Gruparea amino care se schimbă de obicei este amino „alfa”, adică cea care participă la formarea legăturilor peptidice și care definește structura aminoacizilor, deși pot apărea și reacții care implică alte grupe amino prezente în poziții diferite..
Cu excepția lizinei, treoninei, prolinei și hidroxiprolinei, toți aminoacizii participă la reacțiile de transaminare, deși transaminazele au fost descrise pentru histidină, serină, metionină și fenilalanină, dar căile lor metabolice nu implică acest tip de reacții..
Reacțiile de transaminare dintre aminoacizi și α-cetoacizi au fost descoperite în 1937 de Braunstein și Kritzmann și de atunci au făcut obiectul unor studii intensive, deoarece apar în multe țesuturi ale diferitelor organisme și cu scopuri diferite..
La om, de exemplu, transaminazele sunt larg distribuite în țesuturile corpului și sunt deosebit de active în țesutul muscular cardiac, ficatul, țesutul muscular scheletic și rinichii..
Indice articol
- 1 Mecanism de reacție
- 2 Funcția transaminării
- 3 Exemple
- 4 Referințe
Mecanismul de reacție
Reacțiile de transaminare implică mai mult sau mai puțin același mecanism. După cum s-a discutat mai sus, aceste reacții apar ca un schimb reversibil al unei grupări amino între un aminoacid și un α-ceto acid (dezaminat), producând α-cetoacidul aminoacidului donator și aminoacidul α-cetoacidului receptor..
Aceste reacții depind de un compus cunoscut sub numele de piridoxal fosfat, un derivat al vitaminei B6 care participă ca transportator de grupe amino și care se leagă de enzimele transaminazice prin formarea unei baze Schiff între grupul aldehidă al acestei molecule. Și ε-amino a unui reziduu de lizină în situsul activ al enzimei.
Legătura dintre fosfatul piridoxal și reziduul de lizină din situl activ nu este covalentă, ci apare prin interacțiunea electrostatică între sarcina pozitivă a azotului pe lizină și sarcina negativă pe grupul fosfat al piridoxalului.
În cursul reacției, aminoacidul care funcționează ca substrat deplasează gruparea ε-amino a reziduului de lizină din situl activ care participă la baza Schiff cu piridoxal.
Între timp, o pereche de electroni din carbonul alfa al aminoacidului sunt îndepărtați și transferați în inelul piridinic care alcătuiește fosfatul piridoxal (încărcat pozitiv) și apoi „livrați” la acidul α-ceto care funcționează ca un al doilea substrat..
În acest fel, fosfatul piridoxal nu numai că participă la transferul sau transportul grupelor amino între aminoacizi și α-cetoacizi care sunt substraturi ale transaminazelor, dar acționează și ca o „chiuvetă” de electroni, facilitând disocierea hidrogenului alfa aminoacidului.
Pe scurt, primul substrat, un aminoacid, își transferă grupa amino în fosfat piridoxal, de unde este transferat ulterior pe al doilea substrat, un α-ceto acid, formând, între timp, un compus intermediar cunoscut sub numele de piridoxamină fosfat..
Funcția transaminării
Enzimele transaminazei se găsesc în general în citosol și mitocondrie și funcționează în integrarea diferitelor căi metabolice.
Glutamatul dehidrogenază în reacția sa inversă, de exemplu, poate transforma glutamatul în amoniu, NADH (sau NADPH) și α-cetoglutarat, care poate intra în ciclul acidului tricarboxilic și poate funcționa în producția de energie.
Această enzimă, care se află în matricea mitocondrială, reprezintă un punct ramificat care asociază aminoacizii cu metabolismul energetic, astfel încât atunci când o celulă nu are suficientă energie sub formă de carbohidrați sau grăsimi pentru a funcționa, poate folosi alternativ niște aminoacizi scop.
Formarea enzimei (glutamat dehidrogenază) în timpul dezvoltării creierului este esențială pentru controlul detoxifierii amoniului, deoarece s-a demonstrat că unele cazuri de retard mental au legătură cu o activitate scăzută a acestuia, ceea ce duce la acumularea de amoniu, care este dăunătoare sănătății creierului.
În unele celule hepatice, reacțiile de transaminare pot fi utilizate și pentru sinteza glucozei prin gluconeogeneză.
Glutamina este transformată în glutamat și amoniu de către enzima glutaminază. Glutamatul este apoi transformat în α-cetoglutarat, care intră în ciclul Krebs și apoi gluconeogeneză. Acest ultim pas are loc datorită faptului că malatul, unul dintre produsele traseului, este transportat în afara mitocondriilor prin intermediul unei navete..
Această navetă lasă α-cetoglutaratul la mila enzimei malice, care îl transformă în piruvat. Două molecule de piruvat pot fi apoi transformate într-o moleculă de glucoză prin gluconeogeneză..
Exemple
Cele mai frecvente reacții de transaminare sunt legate de aminoacizii alanină, acid glutamic și acid aspartic..
Unele enzime aminotransferază pot utiliza, pe lângă fosfatul piridoxal, piruvatul ca „coenzimă”, cum ar fi glutamatul-piruvatul transaminazei, care catalizează următoarea reacție:
glutamat + piruvat ↔ alanină + α-cetoglutarat
Celulele musculare depind de această reacție pentru a produce alanină din piruvat și pentru energie prin ciclul Krebs prin α-cetoglutarat. În aceste celule, utilizarea alaninei ca sursă de energie depinde de eliminarea grupelor amino, cum ar fi ionii de amoniu din ficat, prin ciclul ureei..
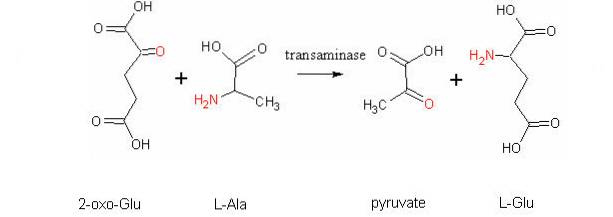
O altă reacție de transaminare foarte importantă la diferite specii este cea catalizată de enzima aspartat aminotransferază:
L-aspartat + α-cetoglutarat ↔ oxaloacetat + L-glutamat
Nu în ultimul rând, reacția de transaminare a acidului γ-aminobutiric (GABA), un aminoacid neproteic esențial pentru sistemul nervos central care funcționează ca un neurotransmițător inhibitor. Reacția este catalizată de o transaminază a acidului γ-aminobutiric și este aproximativ după cum urmează:
α-cetoglutarat + acid 4-aminobutanoic ↔ glutamat + semialdehidă succinică
Semialdehida succinică este transformată în acid succinic printr-o reacție de oxidare și aceasta din urmă poate intra în ciclul Krebs pentru producerea de energie.
Referințe
- Bhagavan, N. V., și Ha, C. E. (2002). Metabolismul proteinelor și aminoacizilor. Biochimie medicală (ediția a IV-a), Academic Press: San Diego, CA, SUA, 331.
- Cammarata, P. S. și Cohen, P. P. (1950). Scopul reacției de transaminare în țesuturile animale. Jurnalul de chimie biologică, 187, 439-452.
- Ha, C. E. și Bhagavan, N. V. (2011). Elementele esențiale ale biochimiei medicale: cu cazuri clinice. Academic Press.
- Litwack, G. (2017). Biochimie umană. Academic Press.
- Rowsell, E. V. (1956). Transaminări cu piruvat și alți α-cetoacizi. Jurnal Biochimic, 64 (2), 246.
- Snell, E. E. și Jenkins, W. T. (1959). Mecanismul reacției de transaminare. Jurnal de fiziologie celulară și comparativă, 54 (S1), 161-177.



Nimeni nu a comentat acest articol încă.