
Tubulin Alpha și Beta, funcții
tubulină este o proteină dimerică globulară formată din două polipeptide: alfa și beta tubulină. Acestea sunt aranjate sub forma unui tub pentru a da naștere microtubulilor, care împreună cu microfilamentele de actină și filamentele intermediare alcătuiesc citoscheletul.
Microtubulii se găsesc în diferite structuri biologice esențiale, cum ar fi flagelii spermei, extensiile organismelor ciliate, cilii traheei și trompelor uterine, printre altele..
În plus, structurile pe care le formează tubulina funcționează ca căi de transport - analog cu liniile unui tren - de materiale și organite din celulă. Deplasarea substanțelor și structurilor este posibilă datorită proteinelor motorii asociate cu microtubuli, numite kinesină și dinină..
Indice articol
- 1 Caracteristici generale
- 2 Alfa și beta tubulină
- 3 Funcții
- 3.1 Citoschelet
- 3.2 Mitoza
- 3.3 Centrosom
- 4 Perspectiva evolutivă
- 5 Referințe
Caracteristici generale
Subunitățile de tubulină sunt heterodimeri de 55.000 daltoni și sunt elementele constitutive ale microtubulilor. Tubulina se găsește în toate organismele eucariote și a fost extrem de conservată de-a lungul evoluției.
Dimerul este alcătuit din două polipeptide numite alfa și beta tubulină. Acestea se polimerizează pentru a forma microtubuli, care constau din treisprezece protofilamente dispuse în paralel sub forma unui tub gol..
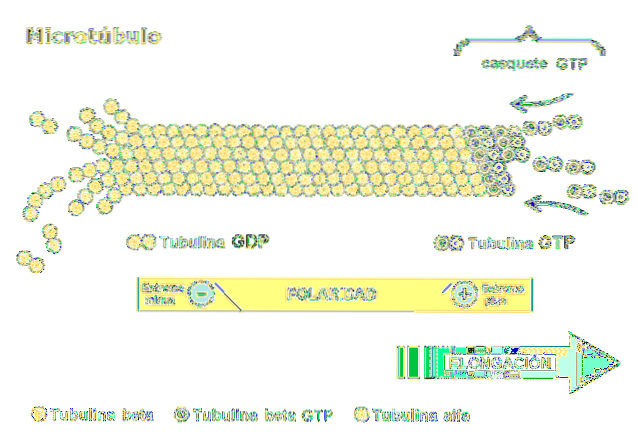
Una dintre cele mai relevante caracteristici ale microtubulilor este polaritatea structurii. Cu alte cuvinte, cele două capete ale microtubulului nu sunt aceleași: un capăt este numit capătul cu creștere rapidă sau „mai mult”, iar celălalt este capătul cu creștere lentă sau „mai puțin”..
Polaritatea este importantă, deoarece determină direcția de mișcare de-a lungul microtubulului. Dimerul de tubulină este capabil de polimerizare și depolarizare în cicluri de asamblare rapidă. Acest fenomen apare și în filamentele de actină.
Există un al treilea tip de subunitate: este gama tubulină. Aceasta nu face parte din microtubuli și este localizată în centrosomi; cu toate acestea, participă la nucleația și formarea microtubulilor.
Tubulină alfa și beta
Subunitățile alfa și beta se asociază puternic pentru a forma un heterodimer complex. De fapt, interacțiunea complexului este atât de intensă încât nu se disociază în condiții normale..
Aceste proteine sunt alcătuite din 550 de aminoacizi, în majoritate acizi. Deși tubulinele alfa și beta sunt destul de asemănătoare, ele sunt codificate de gene diferite..
În tubulina alfa, pot fi găsite reziduuri de aminoacizi cu o grupă acetil, conferindu-i proprietăți diferite în flagelii celulari..
Fiecare subunitate a tubulinei este asociată cu două molecule: în tubulina alfa, GTP se leagă ireversibil și hidroliza compusului nu are loc, în timp ce al doilea loc de legare în beta tubulină, leagă reversibil GTP și îl hidrolizează..
Hidroliza GTP are ca rezultat un fenomen numit „instabilitate dinamică” în care microtubulii suferă cicluri de creștere și declin, în funcție de rata de adăugare a tubulinei și rata de hidroliză GTP..
Acest fenomen are ca rezultat o rată de rotație ridicată a microtubulilor, unde timpul de înjumătățire al structurii este de doar câteva minute..
Caracteristici
Citoschelet
Subunitățile alfa și beta ale tubulinei se polimerizează pentru a da naștere microtubulilor, care fac parte din citoschelet.
Pe lângă microtubuli, citoscheletul este alcătuit din două elemente structurale suplimentare: microfilamente de actină de aproximativ 7 nm și filamente intermediare cu diametrul de 10 până la 15 nm..
Citoscheletul este cadrul celulei, susține și menține forma celulei. Cu toate acestea, membrana și compartimentele subcelulare nu sunt statice și se află în mișcări constante pentru a putea realiza fenomenele de endocitoză, fagocitoză și secreție de materiale..
Structura citoscheletului permite celulei să se acomodeze pentru a îndeplini toate funcțiile menționate anterior..
Este mediul ideal pentru ca organele celulare, membrana plasmatică și alte componente ale celulelor să își îndeplinească funcțiile normale, pe lângă participarea la diviziunea celulară.
De asemenea, ele contribuie la fenomenele de mișcare celulară, cum ar fi locomoția amibei, și la structurile specializate pentru mișcare, cum ar fi cilii și flagelii. În cele din urmă, este responsabil pentru mișcarea mușchilor.
Mitoză
Datorită instabilității dinamice, microtubulii pot fi complet reorganizați în timpul proceselor de diviziune celulară. Dispunerea microtubulilor în timpul interfeței este capabilă să se dezasambleze și subunitățile de tubulină sunt libere.
Tubulina se poate reasambla și poate da naștere fusului mitotic, care este implicat în separarea cromozomilor.
Există anumite medicamente, cum ar fi colchicina, taxolul și vinblastina, care perturbă procesele de diviziune celulară. Acționează direct asupra moleculelor de tubulină, afectând fenomenul de asamblare și disociere a microtubulilor.
Centrosom
În celulele animale, microtubulii se extind până la centrosom, o structură apropiată de nucleu formată dintr-o pereche de centrioli (fiecare orientată perpendicular) și înconjurată de o substanță amorfă, numită matrice pericentriolară..
Centriolii sunt corpuri cilindrice formate din nouă triplete de microtubuli, într-o organizație similară cu cilia și flagelul celular..
În procesul de diviziune celulară, microtubulii se extind de la centrosomi, formând astfel fusul mitotic, responsabil pentru distribuția corectă a cromozomilor către noile celule fiice..
Se pare că centriolii nu sunt esențiali pentru asamblarea microtubulilor în celule, deoarece nu sunt prezenți în celulele vegetale sau în unele celule eucariote, cum ar fi în ovulele anumitor rozătoare.
În matricea pericentriolară, are loc inițierea pentru asamblarea microtubulilor, unde se produce nucleația cu ajutorul tubulinei gamma.
Perspectiva evolutivă
Cele trei tipuri de tubulină (alfa, beta și gamma) sunt codificate de diferite gene și sunt omoloage cu o genă găsită în procariote care codifică o proteină de 40.000-dalton, numită FtsZ. Proteina bacteriană este similară din punct de vedere funcțional și structural cu tubulina.
Este probabil că proteina a avut o funcție ancestrală la bacterii și a fost modificată în timpul proceselor evolutive, concluzionând într-o proteină cu funcțiile pe care le îndeplinește în eucariote..
Referințe
- Cardinali, D. P. (2007). Neuroștiința aplicată: fundamentele sale. Panamerican Medical Ed..
- Cooper, G.M. (2000). Celula: o abordare moleculară. Ediția a II-a. Sunderland (MA): Sinauer Associates.
- Curtis, H. și Schnek, A. (2006). Invitație la biologie. Panamerican Medical Ed..
- Frixione, E. și Meza, I. (2017). Mașini vii: cum se mișcă celulele?. Fondul Culturii Economice.
- Lodish H, Berk A, Zipursky SL și colab. (2000). Biologie celulară moleculară. Ediția a IV-a. New York: W. H. Freeman.

Nimeni nu a comentat acest articol încă.