
Structura, proprietățile și utilizările oxidului de bor (B2O3)
oxid de bor sau anhidridă borică este un compus anorganic a cărui formulă chimică este BDouăSAU3. Deoarece borul și oxigenul sunt elemente ale blocului p al tabelului periodic și chiar mai multe capete ale grupurilor lor respective, diferența de electronegativitate dintre ele nu este foarte mare; prin urmare, este de așteptat ca BDouăSAU3 are o natură covalentă.
BDouăSAU3 Se prepară prin dizolvarea boraxului în acid sulfuric concentrat într-un cuptor de topire și la o temperatură de 750 ° C; acid boric deshidratat termic, B (OH)3, la o temperatură de aproximativ 300 ° C; sau se poate forma și ca produs de reacție al diboranului (BDouăH6) cu oxigen.

Oxidul de bor poate avea un aspect sticlos sau transparent cristalin; acesta din urmă prin măcinare poate fi obținut sub formă de pulbere (imaginea superioară).
Deși poate nu pare așa la prima vedere, este considerat BDouăSAU3 ca unul dintre cei mai complecși oxizi anorganici; nu numai din punct de vedere structural, ci și datorită proprietăților variabile dobândite de ochelari și ceramică la care acest lucru este adăugat la matricea lor.
Indice articol
- 1 Structura oxidului de bor
- 1.1 unitate BO3
- 1.2 Structura cristalină
- 1.3 Structura vitroasă
- 2 Proprietăți
- 2.1 Aspect fizic
- 2.2 Masa moleculară
- 2.3 Aromă
- 2.4 Densitatea
- 2.5 Punct de topire
- 2.6 Punctul de fierbere
- 2.7 Stabilitate
- 3 Nomenclatură
- 4 utilizări
- 4.1 Sinteza trihalidelor de bor
- 4.2 Insecticid
- 4.3 Solvent de oxizi metalici: formarea de sticle, ceramică și aliaje de bor
- 4.4 Liant
- 5 Referințe
Structura oxidului de bor
Unitatea BO3
BDouăSAU3 este un solid covalent, deci teoretic nu există ioni B în structura sa3+ nici ODouă-, dar linkurile B-O. Borul, conform teoriei legăturii de valență (TEV), poate forma doar trei legături covalente; în acest caz, trei obligațiuni B-O. În consecință, geometria așteptată trebuie să fie trigonală, BO3.
Molecula BO3 este deficit de electroni, în special atomi de oxigen; cu toate acestea, mai multe dintre ele pot interacționa între ele pentru a furniza deficiența menționată. Astfel, triunghiurile BO3 se unesc împreună împărtășind un pod de oxigen și sunt distribuite în spațiu ca rețele de rânduri triunghiulare cu planurile lor orientate în moduri diferite.
Structură cristalină
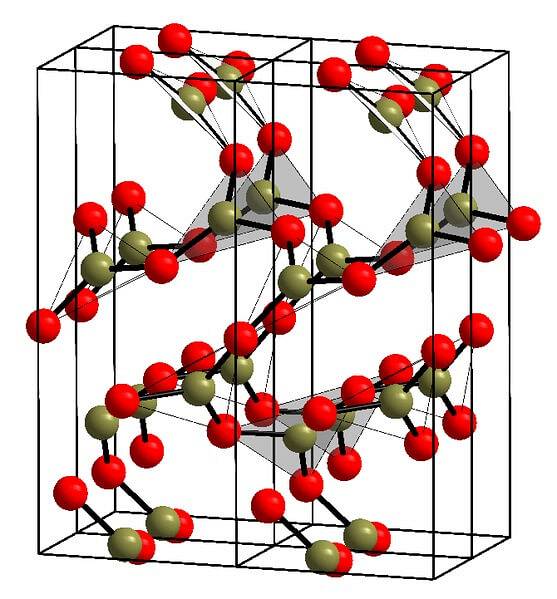
Un exemplu de astfel de rânduri cu unități triunghiulare BO este prezentat în imaginea de mai sus.3. Dacă priviți cu atenție, nu toate fețele planurilor îndreaptă spre cititor, ci invers. Orientările acestor fețe pot fi responsabile pentru modul în care este definit BDouăSAU3 la o anumită temperatură și presiune.
Când aceste rețele au un model structural cu rază lungă de acțiune, acesta este un solid cristalin, care poate fi construit din celula sa unitară. Aici se spune că BDouăSAU3 are două polimorfe cristaline: α și β.
Α-BDouăSAU3 este produs la presiunea ambiantă (1 atm) și se spune că este cinetic instabil; de fapt, acesta este unul dintre motivele pentru care oxidul de bor este probabil un compus dificil de cristalizat.
Celălalt polimorf, β-BDouăSAU3, se obține la presiuni ridicate în gama GPa; prin urmare, densitatea sa trebuie să fie mai mare decât cea a α-BDouăSAU3.
Structura vitroasă
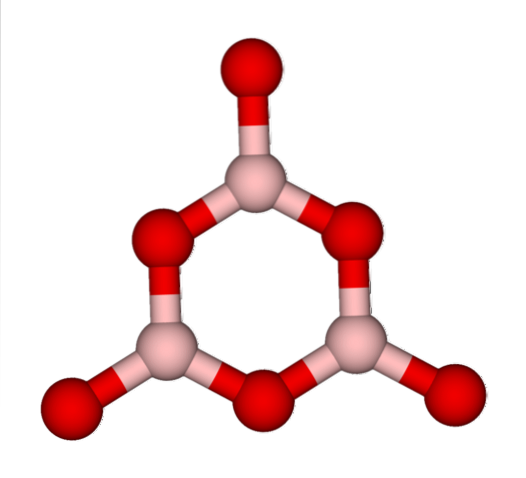
Rețele BO3 ei tind în mod natural să adopte structuri amorfe; Acestea sunt, le lipsește un model care descrie moleculele sau ionii din solid. La sintetizarea BDouăSAU3 forma sa predominantă este amorfă și nu cristalină; în cuvinte corecte: este un solid mai sticlos decât cristalin.
Se spune apoi că BDouăSAU3 este vitros sau amorf atunci când rețelele sale BO3 sunt dezordonati. Nu numai asta, ci și schimbă modul în care se reunesc. În loc să fie aranjate într-o geometrie trigonală, ele ajung să se lege pentru a crea ceea ce cercetătorii numesc un inel boroxol (imaginea de sus).
Observați diferența evidentă dintre unitățile triunghiulare și hexagonale. Triunghiurile caracterizează BDouăSAU3 cristalină și hexagonală la BDouăSAU3 vitros. O altă modalitate de a face referire la această fază amorfă este sticla cu bor sau printr-o formulă: g-BDouăSAU3 („g” provine din cuvântul sticlos, în engleză).
Astfel, rețelele g-BDouăSAU3 sunt compuse din inele boroxol și nu unități BO3. Cu toate acestea, g-BDouăSAU3 poate cristaliza la α-BDouăSAU3, ceea ce ar implica o interconversie a inelelor în triunghiuri și ar defini și gradul de cristalizare atins.
Proprietăți
Aspectul fizic
Este un solid incolor, sticlos. În forma sa cristalină este alb.
Masa moleculara
69,6182 g / mol.
Gust
Puțin amar
Densitate
-Cristalin: 2,46 g / ml.
-Vitros: 1,80g / ml.
Punct de topire
Nu are un punct de topire complet definit, deoarece depinde de cât de cristalină sau vitroasă este. Forma pur cristalină se topește la 450 ° C; cu toate acestea, forma sticloasă se topește într-un interval de temperatură de la 300 la 700 ° C..
Punct de fierbere
Din nou, valorile raportate nu se potrivesc cu această valoare. Aparent oxidul de bor lichid (topit din cristalele sau din sticla sa) fierbe la 1860ºC.
Stabilitate
Trebuie menținut uscat, deoarece absoarbe umezeala pentru a se transforma în acid boric, B (OH)3.
Nomenclatură
Oxidul de bor poate fi numit în alte moduri, cum ar fi:
-Trioxid de Diboron (nomenclatură sistematică).
-Oxid de bor (III) (nomenclatura stocului).
-Oxid boric (nomenclatură tradițională).
Aplicații
Unele dintre utilizările pentru oxidul de bor sunt:
Sinteza trihalidelor de bor
Din BDouăSAU3 pot fi sintetizate trihalide de bor, BX3 (X = F, Cl și Br). Acești compuși sunt acizi Lewis și, cu ei, este posibil să se introducă atomi de bor în anumite molecule pentru a obține alți derivați cu proprietăți noi..
Insecticid
Un amestec solid cu acid boric, BDouăSAU3-B (OH)3, reprezintă o formulă care este utilizată ca insecticid de uz casnic.
Solvent pentru oxizi metalici: formarea de sticle, ceramică și aliaje de bor
Oxidul de bor lichid este capabil să dizolve oxizii metalici. Din acest amestec rezultat, odată răcit, se obțin solide compuse din bor și metale..
În funcție de cantitatea de BDouăSAU3 utilizate, precum și tehnica și tipul de oxid metalic, se poate obține o bogată varietate de pahare (borosilicați), ceramică (nitruri și carburi de bor) și aliaje (dacă se utilizează numai metale).
În general, sticla sau ceramica capătă o rezistență și o rezistență mai mari, precum și o durabilitate mai mare. În cazul ochelarilor, aceștia ajung să fie folosiți pentru lentilele optice și telescopice și pentru dispozitivele electronice..
Liant
În construcția cuptoarelor de topire a oțelului, se utilizează cărămizi refractare pe bază de magneziu. Oxidul de bor este utilizat ca liant, ajutând la menținerea lor strâns împreună..
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Trioxid de bor. Recuperat de pe: en.wikipedia.org
- PubChem. (2019). Oxid boric. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Rio Tinto. (2019). Oxid de borix. 20 Mora Team Borax. Recuperat de pe: borax.com
- A. Mukhanov, O. O. Kurakevich și V. L. Solozhenko. (s.f.). Despre duritatea oxidului de bor (III). LPMTMCNRS, Université Paris Nord, Villetaneuse, Franța.
- Hansen T. (2015). BDouăSAU3 (Oxid boric). Recuperat de pe: digitalfire.com


Nimeni nu a comentat acest articol încă.