
Structura, proprietățile și utilizările oxidului de aur (III) (Au2O3)
oxid de aur (III) este un compus anorganic a cărui formulă chimică este AuDouăSAU3. Teoretic, natura sa ar putea fi de așteptat să fie de tip covalent. Cu toate acestea, prezența unui anumit caracter ionic în solidul său nu poate fi complet exclusă; sau ceea ce este același lucru, presupuneți absența Au cation3+ lângă anionul ODouă-.
Poate părea contradictoriu faptul că aurul, fiind un metal nobil, poate rugini. În condiții normale, bucățile de aur (precum stelele din imaginea de mai jos) nu pot fi oxidate prin contactul cu oxigenul din atmosferă; totuși, atunci când este iradiat cu radiații ultraviolete în prezența ozonului, SAU3, panorama este diferită.

Dacă stelele aurii ar fi supuse acestor condiții, ar avea o culoare maro-roșcat, caracteristică lui AuDouăSAU3.
Alte metode pentru obținerea acestui oxid ar implica tratamentul chimic al stelelor menționate; de exemplu, prin conversia masei de aur în clorura sa respectivă, AuCl3.
Apoi la AuCl3, iar restul sărurilor de aur posibile s-au format, se adaugă un mediu de bază puternic; și cu aceasta se obține oxidul sau hidroxidul hidratat, Au (OH)3. În cele din urmă, acest ultim compus este deshidratat termic pentru a obține AuDouăSAU3.
Indice articol
- 1 Structura oxidului de aur (III)
- 1.1 Aspecte electronice
- 1.2 Hidrați
- 2 Proprietăți
- 2.1 Aspect fizic
- 2.2 Masa moleculară
- 2.3 Densitatea
- 2.4 Punct de topire
- 2.5 Stabilitate
- 2.6 Solubilitate
- 3 Nomenclatură
- 4 utilizări
- 4.1 Colorarea sticlei
- 4.2 Sinteza auratelor și a aurului fulminant
- 4.3 Manipularea monostratelor autoasamblate
- 5 Referințe
Structura oxidului de aur (III)
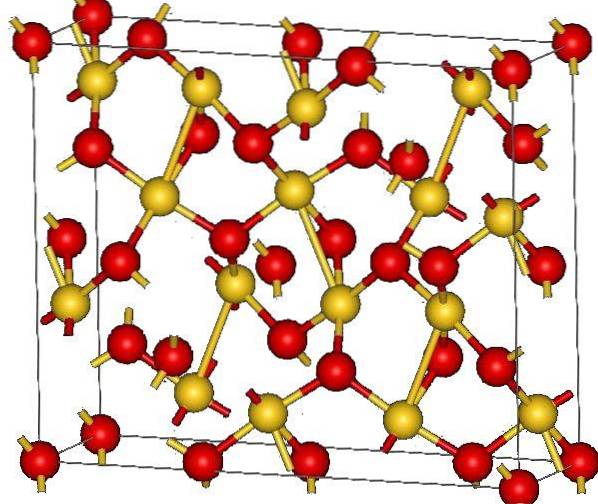
Imaginea superioară arată structura cristalină a oxidului de aur (III). Se arată aranjamentul atomilor de aur și oxigen în solid, fie considerându-i atomi neutri (solid covalent), fie ioni (solid ionic). Indiferent, este suficient să eliminați sau să plasați linkurile Au-O în orice caz.
Conform imaginii, se presupune că predomină caracterul covalent (ceea ce ar fi logic). Din acest motiv, sunt arătați atomii și legăturile reprezentate cu sfere și bare, respectiv. Sferele aurii corespund atomilor de aur (AuIII-O), iar cele roșiatice la atomii de oxigen.
Dacă te uiți atent vei vedea că există unități AuO4, care sunt unite de atomi de oxigen. Un alt mod de a-l vizualiza ar fi să considerăm că fiecare Au3+ este înconjurat de patru O.Două-; desigur, dintr-o perspectivă ionică.
Această structură este cristalină, deoarece atomii sunt dispuși respectând același model de rază lungă. Astfel, celula sa unitară corespunde sistemului cristalin romboedric (același din imaginea superioară). Prin urmare, toate AuDouăSAU3 ar putea fi construite dacă toate acele sfere ale celulei unitare ar fi distribuite în spațiu.
Aspecte electronice
Aurul este un metal de tranziție și se așteaptă ca orbitalii săi 5d să interacționeze direct cu orbitalii 2p ai atomului de oxigen. Această suprapunere a orbitalilor lor ar trebui să genereze teoretic benzi de conducere, care ar converti AuDouăSAU3 într-un semiconductor solid.
Prin urmare, adevărata structură a lui AuDouăSAU3 este chiar mai complex având în vedere acest lucru.
Hidratați
Oxidul de aur poate reține moleculele de apă în cristalele sale romboedrice, dând naștere hidraților. Când se formează astfel de hidrați, structura devine amorfă, adică dezordonată.
Formula chimică pentru astfel de hidrați poate fi oricare dintre următoarele, care, de fapt, nu sunt complet clarificate: AuDouăSAU3∙ zHDouăO (z = 1, 2, 3 etc.), Au (OH)3, sau AuXSAUDa(OH)z.
Formula Au (OH)3 reprezintă o simplificare excesivă a compoziției adevărate a hidraților menționați. Acest lucru se datorează faptului că în cadrul hidroxidului de aur (III), cercetătorii au descoperit și prezența AuDouăSAU3; și, prin urmare, nu are sens să îl tratezi izolat ca pe un „simplu” hidroxid de metal de tranziție.
Pe de altă parte, dintr-un solid cu formula AuXSAUDa(OH)z s-ar putea aștepta o structură amorfă; deoarece, depinde de coeficienți X, Da Da z, ale cărei variații ar da naștere la tot felul de structuri care cu greu ar putea prezenta un model cristalin.
Proprietăți
Aspectul fizic
Este un solid maroniu roșcat.
Masa moleculara
441,93 g / mol.
Densitate
11,34 g / ml.
Punct de topire
Se topește și se descompune la 160 ° C. Prin urmare, îi lipsește un punct de fierbere, astfel încât acest oxid nu ajunge niciodată la fierbere..
Stabilitate
AUDouăSAU3 este termodinamic instabil deoarece, așa cum am menționat la început, aurul nu tinde să se oxideze în condiții normale de temperatură. Deci este ușor de redus pentru a redeveni aurul nobil.
Cu cât temperatura este mai mare, cu atât reacția este mai rapidă, cunoscută sub numele de descompunere termică. Astfel, AuDouăSAU3 la 160ºC se descompune pentru a produce aur metalic și pentru a elibera oxigen molecular:
2 AuDouăSAU3 => 4 Au + 3 ODouă
O reacție foarte similară poate apărea cu alți compuși care promovează reducerea menționată. De ce reducere? Pentru că aurul recâștigă electronii pe care i-a luat oxigenul; ceea ce este la fel ca a spune că pierde legături cu oxigenul.
Solubilitate
Este un solid insolubil în apă. Cu toate acestea, este solubil în acid clorhidric și acid azotic, datorită formării de cloruri de aur și nitrați..
Nomenclatură
Oxidul de aur (III) este denumirea guvernată de nomenclatura stocului. Alte modalități de a o menționa sunt:
-Nomenclatura tradițională: oxid auric, deoarece valența 3+ este cea mai mare pentru aur.
-Nomenclatura sistematică: trioxid de dioro.
Aplicații
Colorarea sticlei
Una dintre utilizările sale cele mai eminente este de a adăuga o culoare roșiatică anumitor materiale, cum ar fi sticla, pe lângă conferirea anumitor proprietăți inerente atomilor de aur..
Sinteza auratelor și a aurului fulminant
Dacă se adaugă AuDouăSAU3 într-un mediu în care este solubil și în prezența metalelor, auratele pot precipita după adăugarea unei baze puternice; care sunt formate din anioni AuO4- în compania cationilor metalici.
De asemenea, AuDouăSAU3 reacționează cu amoniac pentru a forma compusul fulminant de aur, AuDouăSAU3(NH3)4. Numele său derivă din faptul că este extrem de exploziv.
Manipularea monostratelor autoasamblate
Anumiți compuși, cum ar fi dialchil disulfuri, RSSR, nu sunt adsorbiți în același mod pe aur și oxidul său. Când apare această adsorbție, se formează spontan o legătură Au-S, unde atomul de sulf prezintă și definește caracteristicile chimice ale suprafeței menționate în funcție de grupul funcțional de care este atașat..
RSSR-urile nu pot fi adsorbite pe AuDouăSAU3, dar da pe aurul metalic. Prin urmare, dacă suprafața aurului este modificată și gradul său de oxidare, precum și dimensiunea particulelor sau straturilor de AuDouăSAU3, se poate proiecta o suprafață mai eterogenă.
Această suprafață AuDouăSAU3-AuSR interacționează cu oxizii metalici ai anumitor dispozitive electronice, dezvoltând astfel suprafețe viitoare mai inteligente.
Referințe
- Wikipedia. (2018). Oxid de aur (III). Recuperat de pe: en.wikipedia.org
- Formulare chimică. (2018). Oxid de aur (III). Recuperat de pe: formulacionquimica.com
- D. Michaud. (2016, 24 octombrie). Oxizi de aur. 911 Metalurgist. Recuperat de la: 911metallurgist.com
- Shi, R. Asahi și C. Stampfl. (2007). Proprietățile oxizilor de aur AuDouăSAU3 și AuDouăSau: investigația primelor principii. Societatea fizică americană.
- Cook, Kevin M. (2013). Oxidul de aur ca strat de mascare pentru chimia suprafeței regioselective. Teze și disertații. Hârtia 1460.



Nimeni nu a comentat acest articol încă.