
50 Exemple de acizi și baze

Sunt sute exemple de acizi și baze care pot fi găsite în toate ramurile chimiei, dar care în ansamblu sunt separate în două mari familii: anorganice și organice. Acizii anorganici sunt de obicei cunoscuți ca acizi minerali, caracterizați prin faptul că sunt deosebit de puternici în comparație cu cei organici..
Acizii și bazele sunt înțelese ca substanțe care au arome acre sau, respectiv, saponacee. Ambele sunt corozive, deși cuvântul „caustic” este adesea folosit pentru baze puternice. Linia de fund: arde și corodează pielea dacă sunt atinse. Caracteristicile sale în mediile de dizolvare au ghidat o serie de definiții de-a lungul istoriei..
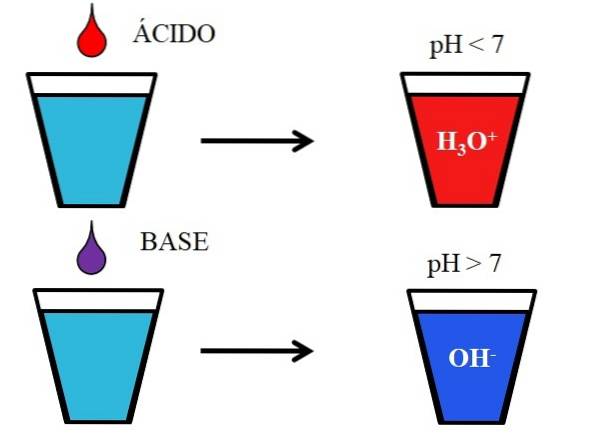
Imaginea de mai jos prezintă comportamentul generic al acizilor și bazelor atunci când acestea sunt adăugate sau dizolvate într-un pahar cu apă. Acizii produc soluții cu valori ale pH-ului sub 7 datorită ionilor de hidroniu, H3SAU+; în timp ce bazele produc soluții cu un pH peste 7 datorită ionilor hidroxil (sau hidroxil), OH-.
Dacă adăugăm acid clorhidric, HCI (picătură roșie), la sticlă, vor exista ioni H3SAU+ și Cl- hidratat. Pe de altă parte, dacă repetăm experimentul cu hidroxid de sodiu, NaOH (picătură purpurie), vom avea ioni OH- și Na+.
Indice articol
- 1 Definiții
- 1.1 Arrhenius
- 1.2 Bronsted-Lowry
- 1.3 Lewis
- 2 Exemple de acizi
- 3 Exemple de baze
- 4 Referințe
Definiții

Caracteristicile tot mai studiate și înțelese ale acizilor și bazelor au stabilit mai multe definiții pentru acești compuși chimici. Printre aceste definiții avem cele ale lui Arrhenius, Bronsted-Lowry și, în cele din urmă, ale lui Lewis. Înainte de a cita exemple, este necesar să fie clar despre acest lucru.
Arrhenius
Acizii și bazele, potrivit lui Arrhenius, sunt acelea care, atunci când sunt dizolvate în apă, produc ioni H3SAU+ sau OH-, respectiv. Adică, imaginea reprezintă deja această definiție. Cu toate acestea, în sine, neglijează unii acizi sau baze prea slabe pentru a produce astfel de ioni. Aici intervine definiția Bronsted-Lowry..
Bronsted-Lowry
Acizii Bronsted-Lowry sunt cei care pot dona ioni H+, iar bazele sunt cele care acceptă aceste H+. Dacă un acid își donează foarte ușor H-ul+, înseamnă că este un acid puternic. La fel se întâmplă și cu bazele, dar acceptând H+.
Astfel, avem acizi și baze puternice sau slabe, iar forțele lor sunt măsurate în solvenți diferiți; în special în apă, din care sunt stabilite unitățile de pH cunoscute (de la 0 la 14).
Prin urmare, un acid acid puternic vă va dona pe deplin H+ la apă într-o reacție de tipul:
HA + HDouăO => A- + H3SAU+
Unde sa- este baza conjugată a HA. De aici vine și H3SAU+ prezent în sticlă cu soluție acidă.
Între timp, o bază B slabă va deprotonona apa pentru a câștiga H-ul respectiv+:
S + HDouăSAU <=> HB + OH-
Unde HB este acidul conjugat al lui B. Acesta este cazul amoniacului, NH3:
NH3 + HDouăSAU <=> NH4+ + Oh-
O bază foarte puternică poate dona direct ioni OH- fără a fi nevoie să reacționeze cu apă; la fel ca NaOH.
Lewis
În cele din urmă, acizii Lewis sunt cei care câștigă sau acceptă electroni, iar bazele Lewis sunt cei care donează sau pierd electroni..
De exemplu, baza NH Bronsted-Lowry3 Este, de asemenea, o bază Lewis, deoarece atomul de azot acceptă un H+ prin donarea perechii sale de electroni liberi (H3N: H+). De aceea cele trei definiții nu sunt în dezacord între ele, ci mai degrabă se împletesc și ajută la studierea acidității și a bazicității într-un spectru mai larg de compuși chimici..
Exemple de acizi
După clarificarea definițiilor, o serie de acizi cu formulele și denumirile respective vor fi menționate mai jos:
-HF: acid fluorhidric
-HBr: acid bromhidric
-HI: acid hidroiodic
-HDouăS: hidrogen sulfurat
-HDouăSe: acid selenhidric
-HDouăCeai: acid telurhidric
Aceștia sunt acizii binari, numiți și hidracizi, de care aparține acidul clorhidric menționat anterior, HCl.
-HNO3: acid azotic
-HNODouă: acid azotat
-HNO: acid hiponit
-HDouăCO3: acid carbonic
-HDouăCODouă: acid carbonic, care este de fapt mai bine cunoscut sub numele de acid formic, HCOOH, cel mai simplu acid organic dintre toate
-H3PO4: acid fosforic
-H3PO3 sau HDouă[HPO3]: acid fosforos, cu o legătură H-P
-H3PODouă sau H [HDouăPODouă]: acid hipofosforos, cu două legături H-P
-HDouăSW4: acid sulfuric
-HDouăSW3: acid sulfuric
-HDouăSDouăSAU7: acid disulfuric
-HIO4: acid periodic
-HIO3: acid iodic
-HIODouă: acid iodat
-HIO: acid hipoiodinic
-HDouăCrO4: acid cromic
-HMnO4: acid manganic
-CH3COOH: acid acetic (oțet)
-CH3SW3H: acid metansulfonic
Toți acești acizi, cu excepția formicului și ultimii doi, sunt cunoscuți ca oxacizi sau acizi ternari..
Alții:
-AlCl3: clorură de aluminiu
-FeCl3: clorură de fier
-BF3: trifluorură de bor
-Cationi metalici dizolvați în apă
-Carbocări
-H (CHBunsprezeceClunsprezece): carborane superacide
- FSO3H: acid fluorosulfonic
- HSbF6: acid fluoroantimonic
- FSO3H SbF5: acid magic
Ultimele patru exemple alcătuiesc super-acizii înfricoșători; compuși capabili să dezintegreze aproape orice material doar prin atingerea acestuia. AlCl3 este un exemplu de acid Lewis, deoarece centrul metalic al aluminiului este capabil să accepte electroni datorită deficienței sale electronice (nu își completează octetul de valență).
Exemple de baze
Printre bazele anorganice avem hidroxizi metalici, cum ar fi hidroxidul de sodiu, și unele hidruri moleculare, cum ar fi amoniacul deja menționat. Iată alte exemple de baze:
-KOH: hidroxid de potasiu
-LiOH: hidroxid de litiu
-RbOH: hidroxid de rubidiu
-CsOH: hidroxid de cesiu
-FrOH: hidroxid de franciu
-Fii (OH)Două: hidroxid de beriliu
-Mg (OH)Două: hidroxid de magneziu
-Ca (OH)Două: hidroxid de calciu
-Sr (OH)Două: hidroxid de stronțiu
-Ba (OH)Două: hidroxid de bariu
-Ra (OH)Două: hidroxid de radiu
-Fe (OH)Două: hidroxid feros
-Fe (OH)3: hidroxid feric
-Al (OH)3: hidroxid de aluminiu
-Pb (OH)4: hidroxid de plumb
-Zn (OH)Două: hidroxid de zinc
-Cd (OH)Două: hidroxid de cadmiu
-Cu (OH)Două: hidroxid cupric
-Ti (OH)4: hidroxid titanic
-PH3: fosfină
-Frasin3: arsine
-NaNHDouă: amidă de sodiu
- C5H5N: piridină
-(CH3) N: trimetilamină
- C6H5NHDouă: fenilamină sau anilină
-NaH: hidrură de sodiu
-KH: hidrură de potasiu
-Carbanioni
-Li3N: nitrură de litiu
-Alcoxizi
-[(CH3)DouăCH]DouăNLi: diizopropilamidă de litiu
-Anion dietinilbenzenic: C6H4C4Două- (cea mai puternică bază cunoscută până acum)
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Naomi Hennah. (10 octombrie 2018). Cum să predați acizii, bazele și sărurile. Recuperat de pe: edu.rsc.org
- Helmenstine, Anne Marie, dr. (31 august 2019). Formule de acizi și baze comune. Recuperat de pe: thoughtco.com
- David Wood. (2019). Compararea acizilor și bazelor obișnuite. Studiu. Recuperat de la: study.com
- Ross Pomeroy. (23 august 2013). Cei mai puternici acizi din lume: ca focul și gheața. Recuperat de pe: realclearscience.com
- Wikipedia. (2019). Dietinilbenzen dianion. Recuperat de pe: en.wikipedia.org

Nimeni nu a comentat acest articol încă.