
Structura, proprietățile, riscurile și utilizările alcoolului butilic terțiar
alcool butilic terțiar este un compus organic a cărui formulă este (CH3)3COH sau t-BuOH. Este cel mai simplu alcool terțiar dintre toate. În funcție de temperatura ambiantă, apare ca un solid sau lichid incolor. Imaginea de mai jos prezintă, de exemplu, cristalele sale incolore.
Acest alcool nu este un substrat pentru enzima alcoolică dehidrogenază și nici pentru activitatea peroxidazică a catalazei, prin urmare este clasificat ca alcool nemetabolizabil. Datorită proprietăților sale biochimice, se crede că ar putea fi util în detectarea radicalilor hidroxil in vivo în celule intacte..

Este unul dintre cei patru izomeri ai alcoolului izobutilic, izomerul fiind cel mai puțin sensibil la oxidare și cel mai puțin reactiv. În natură, se găsește în naut și manioc sau manioc, o rădăcină care este fermentată pentru a produce băuturi alcoolice..
Alcoolul butilic terțiar este foarte solubil în apă și solvenți organici. Utilizarea sa principală este ca solvent, îndeplinind acel rol în producția de materiale plastice, parfumuri, produse de îndepărtare a vopselei etc..
La fel ca mulți compuși organici, este puțin toxic, dar în doze mari are un efect narcotic, caracterizat prin cefalee, amețeli, amețeli, amețeli și amețeli..
Indice articol
- 1 Structura alcoolului terț-butilic
- 2 Proprietăți
- 2.1 Denumiri chimice
- 2.2 Formula moleculară
- 2.3 Greutate moleculară
- 2.4 Descrierea fizică
- 2.5 Miros
- 2.6 Punctul de fierbere
- 2.7 Punctul de topire
- 2.8 Punct de aprindere
- 2.9 Solubilitate în apă
- 2.10 Solubilitate în solvenți organici
- 2.11 Densitatea
- 2.12 Densitatea vaporilor
- 2.13 Presiunea vaporilor
- 2.14 Coeficientul de partiție octanol / apă
- 2.15 Termostabilitate
- 2.16 Temperatura de autoaprindere
- 2.17 Descompunerea
- 2.18 Căldura de vaporizare
- 2.19 Capacitatea calorică
- 2.20 Entalpia de formare
- 2.21 Temperatura de depozitare
- 2.22 Stabilitate
- 2.23 Potențial de ionizare
- 2.24 Pragul mirosului
- 2.25 Indicele de refracție
- 2.26 Constanta de disociere
- 2.27 Concentrația maximă de vapori
- 2.28 Reacții
- 3 Riscuri
- 4 utilizări
- 5 Referințe
Structura alcoolului terț-butilic
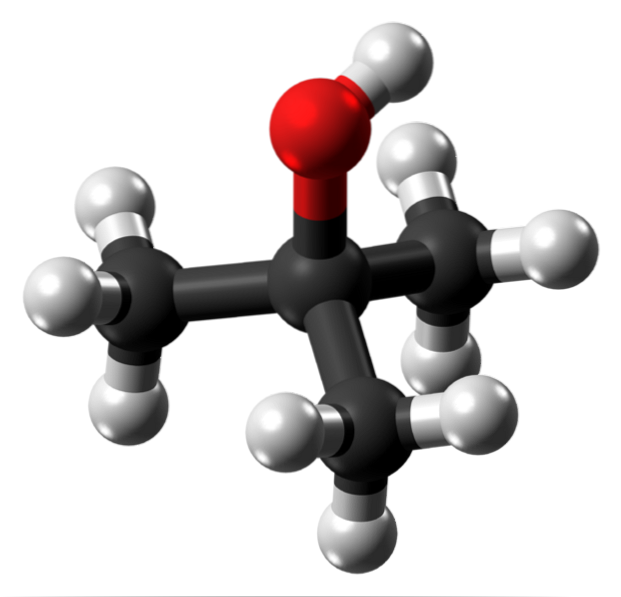
Imaginea superioară arată structura moleculară a alcoolului terț-butilic cu un model de sfere și bare. Întreaga moleculă are o geometrie tetraedrică globală, cu al treilea carbon situat în centrul său și grupurile CH3 și OH la vârfurile sale.
Observând această structură, se înțelege de ce acest alcool este terțiar: carbonul din centru este legat de alți trei atomi de carbon. Continuând cu tetraedrul, partea inferioară a acestuia poate fi considerată apolară, în timp ce vârful său superior, polar.
La acest vârf se află grupul OH, care creează un moment dipolar permanent și permite, de asemenea, moleculelor t-BuOH să interacționeze prin legături de hidrogen; la fel ca în cazul moleculelor de apă și altor substanțe polare.
În cristalele t-BuOH aceste legături de hidrogen sunt un factor cheie pentru ca moleculele să rămână împreună; deși nu există prea multe informații cu privire la care este structura cristalină a acestui alcool.
Deoarece grupul OH este atât de apropiat și înconjurat de grupurile apolare CH3, moleculele de apă reușesc să hidrateze aproape tot alcoolul în același timp în care interacționează cu OH. Acest lucru ar explica marea sa solubilitate în apă..
Proprietăți
Denumiri chimice
-Alcool butilic terțiar
-tert-butanol
-2- metil-2-propanol
-2-metilpropan-2-ol.
Formulă moleculară
C4H10O sau (CH3)3COH.
Greutate moleculară
74,123 g / mol.
Descriere Fizica
Solid incolor sau lichid incolor, în funcție de temperatura ambiantă, deoarece punctul de topire este de 77,9ºF (25,4ºC). Peste 77,9ºF este un lichid.
Miros
Similar cu camforul.
Punct de fierbere
82,4 ºC.
Punct de topire
77,9 ºF (25,4 ºC).
punctul de aprindere
52 ° F (11 ° C). Cupa închisă.
Solubilitatea apei
Foarte solubil. De fapt, indiferent de proporții, acest alcool este întotdeauna miscibil cu apa..
Solubilitate în solvenți organici
Miscibil cu etanol, eter etilic și solubil în cloroform.
Densitate
0,78 g / cm3.
Densitatea vaporilor
2,55 (relativ la aer = 1).
Presiunea de vapori
4,1 kPa la 20 ° C.
Coeficientul de partiție octanol / apă
Jurnal P = 0,35.
Termostabilitate
Instabil în căldură
Temperatură de autoaprindere
896 ºF (470 ºC).
Descompunere
Când este încălzit, poate elibera vapori de monoxid de carbon și izobutilenă.
Căldura de vaporizare
39,07 kJ / mol.
Capacitatea calorică
215,37 JK-1cârtiță-1.
Entalpia de formare
-360,04 până la -358,36 kJmol-1.
Temperatura de depozitare
2-8 ºC.
Stabilitate
Este stabil, dar incompatibil cu agenți oxidanți puternici, cupru, aliaje de cupru, metale alcaline și aluminiu.
Potențial de ionizare
9,70 eV.
Pragul mirosului
219 mg / m3 (miros redus).
Indicele de refracție
1.382 la 25 ° C.
Constanta de disociere
pKa = 19.20.
Concentrația maximă de vapori
5,53% la 25 ° C.
Reacții
-Este deprotonat de o bază puternică pentru a da naștere unui anion alcoxid; în mod specific, un terbutoxid, (CH3)3CO-.
-Alcoolul butilic terțiar reacționează cu clorura de hidrogen pentru a forma clorura de butil terțiară..
(CH3)3COH + HCI => (CH3)3CCl + HDouăSAU
Alcoolii terțiari au o reactivitate mai mare cu halogenurile de hidrogen decât alcoolii secundari și primari.
Riscuri
Alcoolul terț-butilic în contact cu pielea provoacă leziuni minore, cum ar fi eritemul non-sever și hiperemia. De asemenea, nu trece prin piele. Dimpotrivă, în ochi produce iritații severe.
Când este inhalat, irită nasul, gâtul și tuburile bronșice. În caz de expunere ridicată, pot apărea efecte narcotice, o stare de somnolență, precum și amețeală, amețeală și cefalee.
Acest alcool este un agent teratogen experimental, motiv pentru care s-a observat la animale că poate influența apariția tulburărilor congenitale.
În ceea ce privește depozitarea acestuia, lichidul și vaporii săi sunt inflamabili și, prin urmare, în anumite circumstanțe poate genera incendii și explozii..
OSHA a stabilit o limită de concentrație de 100 ppm (300 mg / m3) pentru o schimbare de 8 ore.
Aplicații
-Alcoolul terț-butilic este utilizat pentru încorporarea grupării terț-butil în compuși organici, pentru a prepara rășini solubile în ulei și trinitro-terț-butiltoluen, un mosc artificial. În plus, constituie un material de pornire pentru prepararea peroxizilor.
-A fost aprobat de FDA ca agent antispumant pentru utilizare pe materiale și componente din plastic care vin în contact cu produsele alimentare. A fost utilizat la producerea esențelor de fructe, a materialelor plastice și a lacurilor.
-Este un intermediar pentru producerea de clorură de terț-butil și tributilfenol. Acționează ca un agent denaturant pentru etanol.
-Este utilizat pentru fabricarea agenților de flotație, ca solvent organic pentru îndepărtarea vopselelor și pentru dizolvarea esențelor utilizate în parfumuri..
-Se folosește ca amplificator octanic în benzină; combustibil și aditiv pentru combustibil; solvent pentru a fi utilizat la curățare și ca degresant.
-Alcoolul terț-butilic este un agent intermediar în producția de terț-butilmetil eter (MTBE) și tributiletil eter (ETBE), care reacționează respectiv cu metanol și etanol.
-De asemenea, acționează în același mod în producerea de hidroperoxid de tributil (TBHP) prin reacție cu peroxid de hidrogen..
-Este utilizat ca reactiv în procesul cunoscut sub numele de rearanjare Curtius..
Referințe
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (10a ediție.). Wiley plus.
- Wikipedia. (2019). Alcool terț-butilic. Recuperat de pe: en.wikipedia.org
- Chimie organică comună. (s.f.). t-Butanol. Recuperat de pe: commonorganicchemistry.com
- Centrul Național pentru Informații despre Biotehnologie. (2019). Tert butanol. Baza de date PubChem. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Carey F. A. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.

Nimeni nu a comentat acest articol încă.