
Istoria boraxului, structura, proprietățile, utilizările, sinteza, riscurile
borax sau borat de sodiu este o desemnare pentru un grup de compuși chimici cu formula de bază de NaDouăB4SAU7. Este o sare higroscopică capabilă să formeze numeroși hidrați, pe lângă faptul că este îmbogățită structural de prezența anumitor impurități metalice.
Principalii compuși care primesc denumirea de borax sunt următorii: tetraborat de sodiu anhidru, NaDouăB4SAU7; tetraborat de sodiu pentahidrat (NaDouăB4SAU7) .5HDouăSAU; și tetraborat de sodiu decahidrat, NaDouăB4SAU7.10HDouăSau, sau echivalentul său, tetraborat de sodiu octahidrat, NaDouăB4SAU5(OH)4.8HDouăSAU.

După cum se poate aprecia, toate solidele de mai sus diferă doar prin gradul lor de hidratare; unele au mai multe molecule de apă în cristale decât altele. Fizic, boraxul arată ca niște bucăți robuste sau cristale de cretă (imaginea de sus).
Boraxul se găsește în mod natural în sedimentele sezoniere ale lacurilor, uscate prin evaporare. Boraxul este produs în Turcia, Searles Lakes (California), în deșertul Atacama, Chile, Bolivia, Tibet și România. Cristalele de borax pot fi obținute sintetic printr-un proces lent de nucleație; adică una în care este favorizată creșterea cristalelor.
Tetraboratul de sodiu, anhidru și decahidratat, este slab solubil în apă rece; dar solubilitatea sa crește odată cu creșterea temperaturii. Apoi oDouăB4SAU7.10HDouăSau este foarte solubil în etilen glicol, moderat solubil în etanol și ușor solubil în acetonă; aceștia sunt solvenți mai puțin polari decât apa.
Borax are numeroase aplicații, cum ar fi fabricarea de detergenți și săpunuri; ca ignifug pentru materialul celulozic; în producția de fibră de sticlă; în curățarea suprafețelor dure, cum ar fi metalele, sticla și ceramica; și în inhibarea coroziunii, printre alte utilizări.
Boraxul este iritant pentru ochi, piele și căile respiratorii. Prin ingestie poate produce, printre alte simptome, vărsături, diaree, flaciditate, degradare și convulsii. În prezent, se suspectează că poate avea efecte nocive asupra reproducerii umane.
Indice articol
- 1 Istorie
- 2 Structura boraxului
- 3 cristale
- 3.1 Confuzii cu anionul borat
- 4 Proprietăți
- 4.1 Denumiri
- 4.2 Masa moleculară
- 4.3 Aspect fizic
- 4.4 Densitate
- 4.5 Punct de topire
- 4.6 Punctul de fierbere
- 4.7 Solubilitate în apă
- 4.8 Solubilitatea în solvenți organici
- 4.9 Indicele de refracție (ηD)
- 4.10 Stabilitate
- 4.11 Emisia de lumină
- 4.12 Reacții
- 5 utilizări
- 5.1 Acțiune antioxidantă
- 5.2 Fabricarea adezivilor
- 5.3 ignifug
- 5.4 Fabricarea sticlei borosilicate (Pyrex)
- 5.5 Emulgator
- 5.6 Material de curățare
- 5.7 Utilizări medicale
- 5,8 tampon pH
- 5.9 Scăderea durității apei
- 5.10 Îngrășăminte și compost
- 5.11 Conservarea lemnului
- 5.12 Flux și flux
- 5.13 Altele
- 6 Sinteza
- 7 Riscuri
- 8 Referințe
Poveste
Istoria boraxului este confuză. Se spune că a fost descoperit în albia unui lac din Tibet, uscat prin evaporare. A fost transferat în secolul al VIII-lea din Tibet în Arabia Saudită, urmând așa-numitul Drum al Mătăsii.
Termenul „borax” a devenit popular ca urmare a numeroaselor aplicații care au fost găsite și comercializate sub numele de 20 Mule Team Borax Tradermax, care se referea la modul în care boraxul era transportat prin deșerturile din Nevada și California.
O altă versiune a descoperirii sale indică faptul că egiptenii știau de existența ei de mult timp, folosindu-l în sudarea metalelor prin căldură. În plus, l-au folosit în medicină și în procesul de mumificare. Boraxul a fost transferat în Europa în secolul al XIII-lea de Marco Polo.
La mijlocul secolului al XIX-lea, în deșertul Mogave au fost descoperite depozite mari de borax, care și-a făcut utilizarea obișnuită de atunci..
Structura boraxului

Imaginea superioară arată ionii care alcătuiesc boraxul, corespunzător în mod specific unui solid cu o formulă compozițională de NaDouă[B4SAU5(OH)4] · 8HDouăO (sau NaDouăB4SAU710HDouăSAU).
În primul rând, structura în cuști a anionului [B4SAU5(OH)4]Două- (deși ar trebui să aibă două grupuri -OH deprotonate, -O-), în care poate fi văzut un inel octogonal (patru atomi B și patru O), cu un pod B-O-B care îl împarte în două jumătăți.
Cusca menționată nu rămâne statică, ci vibrează și adoptă diferite forme în spațiu; cu toate acestea, într-o măsură mai mică în vecinătatea podului. De asemenea, se poate observa că este foarte „oxigenat”; adică are mulți atomi de oxigen, capabili să interacționeze cu moleculele de apă prin legături de hidrogen.
Atunci nu este surprinzător faptul că cristalele de borax se pot hidrata și pot genera numeroși hidrați. Astfel, pentru Na solidDouă[B4SAU5(OH)4] · 8HDouăSau, există opt molecule de HDouăSau interacționând cu cușca boratului și, în același timp, cu centrele metalice ale Na+.
Pe partea cationică, avem complexul apos [Na (HDouăSAU)4]+n, unde valoarea lui n va depinde de raportul anion / cation. În solidul superior, n = 2, deci avem: [NaDouă(HDouăSAU)8]Două+, a cărei sarcină 2+ neutralizează sarcina 2 a anionului borat.
Cristale
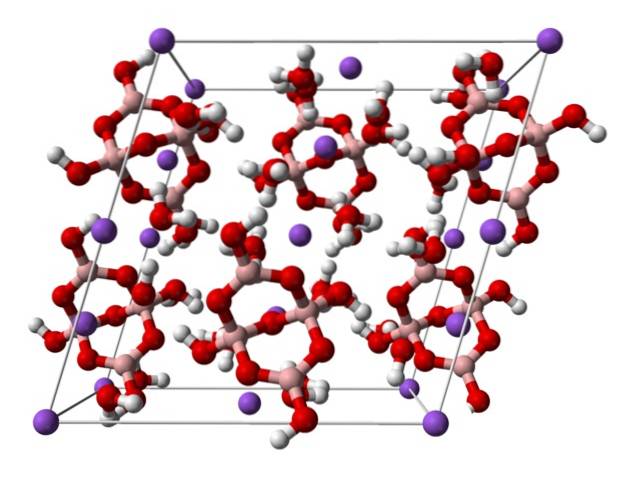
domeniu].
Deasupra este celula monoclinică pentru cristale de NaDouă[B4SAU5(OH)4] · 8HDouăO sau NaDouăB4SAU710HDouăO. Aici atracțiile electrostatice și legăturile de hidrogen guvernează sau domină modelele structurale originate în fiecare întindere a cristalului..
Ceilalți hidrați și sarea anhidră își pierd una sau toate moleculele de apă, modificând compoziția și structura cristalului de borax. În toate acestea, anionul și cationul rămân aceleași (cu excepția cazului în care există impurități sau reacții adverse), deci nu poate exista confuzie în acest sens..
Confuzii cu anionul borat
N / ADouă[B4SAU5(OH)4] · 8HDouăO și NaDouăB4SAU710HDouăSau sunt la fel. De ce?
În primul rând, dacă îi numeri atomii, se va vedea că aceștia coincid la număr; și în al doilea rând, în anionul B4SAU7Două- se ia în considerare absența celor două grupuri OH legate de capetele de bor ale podurilor B-O-B; doi OH care, împreună cu cei doi H+ provenind din B4SAU7Două-, se adaugă 2 HDouăSau, oferind un total de 10 HDouăSau (8 + 2).
Proprietăți
Numele
- Borax.
- Borat de sodiu.
- Tetraborat de sodiu.
- Tetraborat disodic.
Masa moleculara
Anhidru: 201,22 g / mol.
Decahidrat: 381,38 g / mol.
Aspectul fizic
Un solid cristalin alb.
Densitate
Anhidru: 2,4 g / cm3
Decahidrat: 1.739 g / cm3
Punct de topire
Anhidru: 743ºC (1.369ºF, 1.016K).
Decahidrat: 75 ºC.
Punct de fierbere
Anhidru: 1.575 ºC (2.867 ºF, 1.848 K).
Solubilitatea apei
31,78 g / L (atât pentru anhidru, cât și pentru decahidrat).
Solubilitate în solvenți organici
Este foarte solubil în etilen glicol, moderat solubil în dietilen glicol și metanol și ușor solubil în acetonă..
Indicele de refracție (ηD)
Anhidru: η1 = 1.447; ηDouă = 1.469.
Decahidrat: ηDouă = 1.472.
Stabilitate
Este stabil în condiții adecvate de depozitare. Deși are o presiune de vapori scăzută, crește odată cu temperatura, ducând la cristalizare și condensare, astfel încât fluctuațiile excesive de temperatură și umiditate trebuie evitate..
Emisia de lumină
Tetraboratul de sodiu atunci când este supus acțiunii focului emite o lumină verde.
Reacții
- Când se dizolvă în apă, produce soluții alcaline cu un pH de aproximativ 9,2.
- Boraxul reacționează pentru a forma alți borați, cum ar fi perboratul (PBS).
- De asemenea, produce acid boric prin reacția cu acidul clorhidric:
N / ADouăB4SAU710HDouăO + HCI => 4 H3BO3 + 2 Na+ + 2 Cl- + 5 oreDouăSAU
- Tetraboratul de sodiu se comportă ca o substanță amfoteră, deoarece într-o soluție apoasă se hidrolizează și este capabil să neutralizeze acizii. În același mod, este capabil să neutralizeze alcalii cu concentrație ridicată, evitând o creștere excesivă a pH-ului mediului..
Aplicații
Borax are numeroase aplicații, atât la oameni, cât și în toate activitățile pe care le desfășoară..
Acțiune antioxidantă
Boraxul are capacitatea de a dizolva oxizii. Din acest motiv, este utilizat în recuperarea metalelor precum alama, cuprul, plumbul și zincul..
Este, de asemenea, utilizat pentru a preveni oxidarea barelor metalice în turnătorii. Boraxul își acoperă suprafața, excluzând aerul și, prin urmare, prevenind oxidarea. În plus, previne coroziunea materialelor feroase în fabricarea automobilelor.
Solubilitatea boraxului în etilen glicol a fost utilă în formulările antigel. Boraxul neutralizează reziduurile acide care sunt produse în timpul descompunerii etilenglicolului, minimizând oxidarea pe care o poate supune suprafața metalelor.
Fabricarea adezivilor
- Borax face parte dintr-o formulare adezivă de amidon pentru hârtie și carton ondulat.
- Este un agent peptizant în fabricarea adezivilor pe bază de cazeină și dextrină.
- Funcționează prin întărirea materialelor adezive prin reticularea grupărilor hidroxil conjugate.
Ignifug
Este utilizat ca ignifug în materialele celulozice și în alți polimeri care conțin grupări hidroxil. Acesta își exercită acțiunea prin diferite mecanisme, inclusiv formarea unui strat vitros care limitează accesul la combustibili.
Fabricarea sticlei borosilicate (Pyrex)
Boraxul este o sursă de bor utilizat la fabricarea sticlei borosilicate; caracterizat printr-un punct de topire ridicat, un coeficient de expansiune redus și o rezistență ridicată la șoc termic.
Acest lucru îi permite să fie supus unor temperaturi ridicate, fără a suferi fracturi, primind denumirea de sticlă refractară..
Sticla borosilicată este utilizată la fabricarea materialelor care urmează să fie folosite în casă pentru coacerea alimentelor. De asemenea, este utilizat în laboratoare în pahare, flacoane, cilindri de măsurare, pipete etc..
Emulgator
Boraxul, împreună cu alți compuși, este utilizat pentru a emulsiona săpunurile și alte parafine. Este, de asemenea, utilizat ca bază pentru producția de loțiuni, creme și unguente..
Produse de curatat
- Se adaugă în formulări pentru curățarea suprafețelor ferme, cum ar fi metalele, sticla și ceramica.
- Se folosește în produsele de curățat mâinile, materialele de lustruit și săpunurile de detergent pentru utilizare în spălătorii și acasă. În plus, facilitează îndepărtarea depozitelor uleioase de pe podeaua fabricii.
Utilizări medicale
- Este utilizat în tratamentul infecțiilor fungice ale picioarelor.
- Face parte din formula nutrienților care furnizează bor. Se crede că acest element este implicat în metabolismul calciului, fosforului și magneziului și poate fi necesar pentru structura osoasă.
- Este implicat în determinarea hemoglobinei glicozilate (HbA1C), un test care servește la determinarea dezvoltării pe termen lung a diabetului la un pacient, deoarece timpul de înjumătățire al unui eritrocit este de 120 de zile.
Aceste informații sunt mai utile clinicianului decât măsurătorile individuale ale glicemiei de la pacient..
Tampon PH
Este utilizat în diferite sisteme tampon utilizate în biochimie; printre acestea, Tris (hidroximetil) aminometan-boratul, utilizat în electroforeza poliacrilamidică a ADN-ului și a acizilor nucleici ARN.
Scăderea durității apei
Boraxul se poate combina cu ionii de calciu și magneziu prezenți în apă, reducând concentrația acestora. În acest fel se reduce duritatea apei.
Îngrășăminte și compost
Boraxul este folosit ca sursă de bor. Calciul și borul sunt implicate în formarea peretelui celular al plantei. În plus, s-a subliniat că borul favorizează polenizarea, motiv pentru care intervine în fertilizarea și proliferarea plantelor.
Conservarea lemnului
Borax combate viermele de lemn, un gândac care consumă și distruge lemnul. Este, de asemenea, utilizat în conservarea și întreținerea ambarcațiunilor din lemn.
Flux și flux
Este utilizat ca flux în sudarea oțelului și fierului, provocând o scădere a punctului de topire și eliminarea oxidului de fier; un contaminant nedorit. Într-un scop similar, el participă la lipirea aurului și argintului.
Alții
- Este folosit ca pesticid ușor; de exemplu, pentru a combate molii pe lână.
- Pulverizarea este utilizată pentru combaterea dăunătorilor prezenți în dulapuri, rezervoare interne, în golurile pereților și, în general, unde nu se dorește utilizarea unor pesticide mai poluante..
- Este utilizat în reactoarele nucleare pentru a controla reacțiile care ar putea produce, în cazuri extreme, o reacție în lanț.
- În radiatoarele auto, boraxul este utilizat pentru a bloca locurile în care există scurgeri de apă.
Sinteză
Boraxul se obține prin reacția ulexitului mineral, compus din elementele bor, sodiu și calciu, cu formula NaCaB5SAU9.8HDouăSau, cu carbonat de sodiu și hidrocarbonat de sodiu în mediu apos.
De fapt, sinteza tetraboratului de sodiu sau a boraxului este puțin utilizată; majoritatea compusului produs se obține prin extragerea mineralelor care îl conțin.
Procesul poate fi rezumat printr-o dizolvare a minereului în apă, urmată de o filtrare în argilă și în final o evaporare a soluției apoase.
Riscuri
Boraxul este un produs natural, cu toate acestea, poate provoca o serie de daune sănătății umane. De exemplu, contactul cu pudra de borax poate provoca iritarea pielii care ar putea duce la dermatită..
În mod similar, boraxul provoacă iritarea ochilor și a căilor respiratorii superioare. Simptomele inhalării sale includ tuse și dureri în gât.
Între timp, aportul de borax prezintă următoarele simptome: vărsături, greață, diaree, flaciditate, cefalee și convulsii. În plus, sistemul nervos central și funcția renală pot fi afectate..
Din studiile efectuate la șobolani masculi, hrăniți cu borax, la aceștia s-a observat atrofie testiculară. În timp ce studiile efectuate cu șobolani femele însărcinate au indicat faptul că boraxul ar putea traversa placenta, producând o alterare a dezvoltării fetale, manifestată prin greutate redusă la naștere.
Se crede că expunerea la borax afectează funcția de reproducere masculină la bărbați, manifestată printr-o reducere a numărului de spermatozoizi.
Se estimează o doză fatală de 10 până la 25 de grame pentru aportul de borax la adulți.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Centrul Național pentru Informații despre Biotehnologie. (2019). Argon. Baza de date PubChem. CID = 23968. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Karolyn Burns, Seneca Joseph și Dr. Ryan Baumbach. (s.f.). Sinteza și proprietățile cristalelor de borax și ale aliajelor intermetalice. Recuperat de pe: nationalmaglab.org
- Wikipedia. (2019). Borax. Recuperat de pe: en.wikipedia.org
- Rio Tinto. (2019). Borax decahidrat. 20 Mora Team Borax. Recuperat de pe: borax.com
- Fletcher Jenna. (14 ianuarie 2019). Este borax sigur de utilizat? Recuperat de pe: medicalnewstoday.com



Nimeni nu a comentat acest articol încă.