
Alotropie Transformare alotropică și elemente principale

alotropie în chimie este caracteristica pe care o au anumite elemente chimice de a se prezenta în mai multe forme diferite, dar în aceeași stare de agregare a materiei. Structura elementelor poate varia în funcție de dispunerea moleculară a acestora și de condițiile în care sunt formate, cum ar fi presiunea și temperatura..
Numai când vine vorba de elemente chimice se folosește cuvântul alotropie, desemnând fiecare dintre modurile în care un element poate fi găsit în aceeași fază ca un alotrop; întrucât pentru compușii care prezintă structuri cristaline diferite nu se aplică; în acest caz se numește polimorfism.
Se cunosc și alte cazuri, cum ar fi cel al oxigenului, în care alotropia poate apărea ca o modificare a numărului de atomi ai substanței. În acest sens, există o noțiune de două alotrope ale acestui element, care sunt mai bine cunoscute sub numele de oxigen (ODouă) și ozon (O3).
Indice articol
- 1 Transformarea alotropică
- 2 Principalele elemente alotrope
- 2.1 Carbon
- 2.2 Sulf
- 2.3 Fosfor
- 2.4 Oxigen
- 3 Referințe
Transformarea alotropică
După cum sa menționat anterior, alotropii sunt diferitele moduri în care poate fi găsit același element, astfel încât această variație a structurii sale face ca aceste specii să apară cu caracteristici fizice și chimice diferite..
La fel, transformarea alotropică dintre un element și altul are loc prin modul în care atomii sunt dispuși în interiorul moleculelor; adică modul în care își are originea legătura.
Această schimbare între un alotrop și altul poate avea loc din diferite motive, cum ar fi modificări ale condițiilor de presiune, temperatură și chiar incidența radiației electromagnetice, cum ar fi lumina..
Atunci când structura unei specii chimice este modificată, aceasta își poate schimba și comportamentul, modificând proprietăți precum conductivitatea electrică, duritatea (în cazul substanțelor solide), punctul de topire sau de fierbere și chiar calitățile fizice, cum ar fi culoarea sa..
În plus, alotropia poate fi de două tipuri:
- Monotrop, atunci când una dintre structurile elementelor are o stabilitate mai mare decât celelalte în toate condițiile.
- Enantropic, când diferitele structuri sunt stabile în condiții diferite, dar se pot transforma una în cealaltă într-un mod reversibil la anumite presiuni și temperaturi.
Principalele elemente alotrope
Deși există mai mult de o sută de elemente cunoscute în tabelul periodic, nu toate au forme alotrope. Cele mai cunoscute alotrope sunt prezentate mai jos.
Carbon
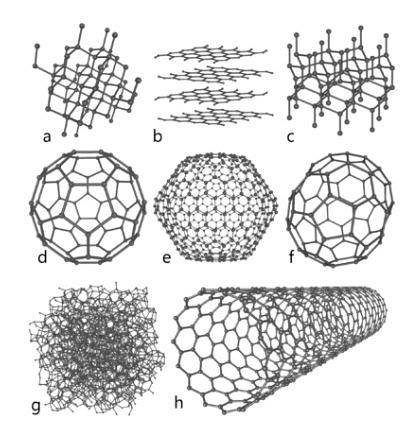
Acest element de mare abundență în natură reprezintă baza fundamentală a chimiei organice. Sunt cunoscute mai multe specii alotrope, printre care se remarcă diamantul, grafitul și altele care vor fi expuse mai jos..
Diamant
Diamantul prezintă o dispunere moleculară sub formă de cristale tetraedrice ai căror atomi sunt legați prin legături simple; asta înseamnă că sunt aranjate prin hibridizare sp3.
Grafit
Grafitul este alcătuit din foi consecutive de carbon, unde atomii săi sunt legați în structuri hexagonale prin legături duble; adică cu hibridizare spDouă.
Carbino
În plus față de cele două alotrope importante menționate mai sus, care sunt cele mai cunoscute dintre carbon, există și altele precum carbina (așa cum este cunoscut și carbonul acetilenic liniar, LAC), unde atomii săi sunt aranjați într-un mod liniar prin legături triple; adică cu hibridizare sp.
Alții
- Grafen, a cărui structură este foarte asemănătoare cu grafitul).
- Fullerene sau buckminsterfullerene, cunoscute și sub numele de buckyball, a căror structură este hexagonală, dar atomii săi sunt dispuși în formă de inel.
- Nanotuburi de carbon, de formă cilindrică.
- Carbon amorf, fără structură cristalină.
Sulf
Sulful are, de asemenea, mai multe alotrope considerate comune, precum următoarele (trebuie remarcat faptul că toate acestea sunt în stare solidă):
Sulful rombic
După cum sugerează și numele său, structura sa cristalină este formată din romburi octogonale și este, de asemenea, cunoscută sub numele de sulf α..
Sulf monoclinic
Cunoscut sub numele de β sulf, are forma unei prisme formate din opt atomi de sulf.
Sulf topit
Produce cristale prismatice stabile la anumite temperaturi, formând ace lipsite de culoare..
Sulful plastic
Numit și sulf, are o structură amorfă.
Sulf lichid
Are caracteristici de vâscozitate contrare majorității elementelor, deoarece în acest alotrop crește odată cu creșterea temperaturii.
Meci
Acest element nemetalic se găsește în mod obișnuit în natură în combinație cu alte elemente și are mai multe substanțe alotrope asociate:
Fosfor alb
Este un solid cu o structură cristalină tetraedrică și are aplicații în domeniul militar, fiind chiar folosit ca armă chimică..
Fosfor negru
Are cea mai mare stabilitate dintre alotropii acestui element și este foarte asemănător cu grafenul.
Fosfor roșu
Formează un solid amorf cu proprietăți reducătoare, dar este lipsit de toxicitate.
Difosfor
După cum indică și numele, este alcătuit din doi atomi de fosfor și este o formă gazoasă a acestui element.
Fosfor violet
Este un solid cu o structură cristalină cu un aranjament molecular monoclinic..
Fosfor stacojiu
De asemenea, structură solidă amorfă.
Oxigen
În ciuda faptului că este unul dintre cele mai comune elemente din atmosfera Pământului și unul dintre cele mai abundente elemente din univers, are puține alotrope cunoscute, printre care se remarcă dioxigenul și trioxigenul..
Dioxigen
Dioxigenul este mai bine cunoscut sub numele simplu de oxigen, o substanță gazoasă esențială pentru procesele biologice ale acestei planete..
Trioxigen
Trioxigenul este mai bine cunoscut sub numele de ozon, un alotrop extrem de reactiv a cărui funcție cea mai faimoasă este de a proteja atmosfera Pământului de sursele de radiații externe..
Tetraoxigen
Formează o fază solidă a structurii trigonale cu caracteristici de metastabilitate.
Alții
Există, de asemenea, alte șase specii solide care se formează oxigen, cu structuri cristaline diferite..
În același mod, există elemente precum seleniu, bor, siliciu, printre altele, care prezintă alotropi diferiți și care au fost studiate cu un grad mai mic sau mai mare de adâncime..
Referințe
- Wikipedia. (s.f.). Alotropie. Recuperat de pe en.wikipedia.org
- Chang, R. (2007). Chimie, ediția a IX-a. Mexic: McGraw-Hill.
- Britannica, E. (s.f.). Alotropie. Adus de la britannica.com
- ThoughtCo. (s.f.). Definiție și exemple de alotrop. Recuperat de la thoughtco.com
- Ciach, R. (1998). Aliaje de lumină și compozite avansate. Obținut din books.google.co.ve




Nimeni nu a comentat acest articol încă.