
Structura aminelor, proprietăți, tipuri, utilizări, exemple
amine sunt compuși organici derivați din amoniac. În ele există legături covalente între carbon și azot. În mod natural, molecula de azot este cinetică inertă; dar datorită fixării biologice, acesta este transformat în amoniac, care, la rândul său, suferă reacții ulterioare de alchilare.
Când amoniacul este „alchilat”, acesta înlocuiește unul, doi sau trei dintre cei trei hidrogeni ai săi cu atomi de carbon. Acești carboni pot proveni dintr-o grupare alchil (R) sau arii (Ar). Astfel, există amine alifatice (liniare sau ramificate) și aromatice.

Formula generală pentru aminele alifatice este prezentată mai sus. Această formulă poate fi utilizată pentru aminele aromatice, având în vedere că R poate fi, de asemenea, o grupare arii Ar. Observați similaritatea dintre amină și amoniac, NH3. Practic, un H a fost înlocuit cu un lanț lateral R.
Dacă R constă din lanțuri alifatice, aveți ceea ce este cunoscut sub numele de alchilamină; în timp ce dacă R are o natură aromatică, o arilamină. Dintre arilamine, cea mai importantă dintre toate este alanina: o grupare amino, -NHDouă, legat de inelul benzenic.
Când există grupări oxigenate într-o structură moleculară, cum ar fi OH și COOH, compusul nu mai este numit amină. În acest caz, amina este considerată un substituent: gruparea amino. De exemplu, acest lucru apare la aminoacizi, precum și la alte biomolecule de o importanță enormă pentru viață..
Deoarece azotul se găsește în mulți dintre compușii esențiali pentru viață, aceștia au fost considerați ca amine vitale; adică „vitamine”. Cu toate acestea, multe dintre vitamine nu sunt nici măcar amine și, în plus, nu toate sunt vitale pentru viață. Cu toate acestea, acest lucru nu neagă importanța sa mare în organismele vii..
Aminele sunt baze organice mai puternice decât amoniacul în sine. Sunt ușor de extras din materie vegetală și, în general, au interacțiuni puternice cu matricea neuronală a organismelor; prin urmare, multe medicamente și medicamente constau în amine cu structuri complexe și substituenți.
Indice articol
- 1 Structură
- 2 Proprietățile aminelor
- 2.1 Polaritate
- 2.2 Caracteristici fizice
- 2.3 Solubilitatea în apă
- 2.4 Baza
- 3 tipuri (primar, secundar, terțiar)
- 4 Instruire
- 4.1 Alchilarea amoniacului
- 4.2 Hidrogenarea catalitică
- 5 Nomenclatură
- 6 utilizări
- 6.1 Coloranți
- 6.2 Droguri și droguri
- 6.3 Tratarea gazelor
- 6.4 Chimie agricolă
- 6.5 Fabricarea rășinilor
- 6.6 Nutrienți pentru animale
- 6.7 Industria cauciucului
- 6.8 Solvenți
- 7 Exemple
- 7.1 Cocaina
- 7.2 Nicotina
- 7.3 Morfină
- 7.4 Serotonina
- 8 Referințe
Structura
Care este structura sa? Deși variază în funcție de natura lui R, mediul electronic al atomului de azot este același pentru toți: tetraedru. Dar, deoarece există o pereche de electroni nepartajați pe atomul de azot (··), geometria moleculară devine piramidală. Acest lucru este valabil pentru amoniac și amine.
Aminele pot fi reprezentate de un tetraedru, la fel ca compușii de carbon. Astfel, NH3 și CH4 sunt desenate ca tetraedre, unde perechea (··) este situată la unul dintre vârfurile de deasupra azotului.
Ambele molecule sunt achirale; totuși, ei încep să prezinte chiralitate, deoarece H-urile lor sunt înlocuite cu R. Amina RDouăNH este achiral dacă cele două R sunt diferite. Cu toate acestea, îi lipsește orice configurație pentru a diferenția un enantiomer de altul (cum este cazul centrelor de carbon chirale).
Acest lucru se datorează faptului că enantiomerii:
RDouăN-H | H-NRDouă
sunt schimbați într-un asemenea ritm încât niciunul dintre ei nu se poate izola; și, prin urmare, structurile aminelor sunt considerate achirale, chiar dacă toți substituenții de pe atomul de azot sunt diferiți.
Proprietățile aminelor
Polaritate
Aminele sunt compuși polari, deoarece grupa amino NHDouă, având un atom de azot electronegativ, acesta contribuie la momentul dipol al moleculei. Rețineți că azotul are capacitatea de a dona legături de hidrogen, ceea ce face ca aminele să aibă în general puncte de fierbere și de topire ridicate..
Cu toate acestea, atunci când această proprietate este comparată cu cea a compușilor oxigenați, cum ar fi alcoolii și acizii carboxilici, acestea duc la magnitudini mai mici..
De exemplu, punctul de fierbere al etilaminei, CH3CHDouăNHDouă (16,6ºC) este mai mică decât cea a etanolului, CH3CHDouăOH (78ºC).
Astfel, se arată că legăturile de hidrogen O-H sunt mai puternice decât cele ale N-H, chiar dacă o amină poate forma mai mult de o punte. Această comparație este valabilă numai dacă R are aceeași greutate moleculară pentru cei doi compuși (CH3CHDouă-). Pe de altă parte, etanul fierbe la -89 ° C, CH3CH3, fiind un gaz la temperatura camerei.
Deoarece o amină are mai puțin hidrogen, formează mai puține legături de hidrogen și punctul său de fierbere este redus. Acest lucru se vede comparând punctul de fierbere al dimetilaminei, (CH3)DouăNH (7ºC), cu cel al etilaminei (16,6ºC).
Caracteristici fizice
În lumea chimiei, când vorbești despre o amină, apare actul involuntar de a-ți ține nasul. Acest lucru se datorează faptului că, în general, tind să aibă mirosuri neplăcute, dintre care unele ajung să semene cu ale peștilor putreziți..
În plus, aminele lichide tind să aibă tonuri gălbui, ceea ce crește neîncrederea vizuală pe care o generează..
Solubilitatea apei
Aminele tind să fie insolubile în apă deoarece, în ciuda faptului că pot forma legături de hidrogen cu HDouăSau, componenta sa organică majoră este hidrofobă. Cu cât grupele R sunt mai mari sau mai lungi, cu atât solubilitatea lor în apă este mai mică..
Cu toate acestea, când există un acid în mediu, solubilitatea este crescută prin formarea a ceea ce este cunoscut sub numele de săruri de amină. În ele, azotul are o sarcină parțială pozitivă, care atrage electrostatic anionul sau baza conjugată a acidului..
De exemplu, într-o soluție diluată de HCI, amina RNHDouă reacționează după cum urmează:
RNHDouă + HCI => RNH3+Cl- (sare primară de amină)
RNHDouă A fost insolubil (sau ușor solubil) în apă, iar în prezența acidului formează o sare, a cărei solvatare a ionilor săi favorizează solubilitatea sa.
De ce se întâmplă asta? Răspunsul constă într-una dintre principalele proprietăți ale aminelor: acestea sunt polare și de bază. Deoarece sunt de bază, vor reacționa cu acizi suficient de puternici pentru a-i protona, conform definiției Brönsted-Lowry..
Basicitate
Aminele sunt baze organice mai puternice decât amoniacul. Cu cât densitatea electronilor este mai mare în jurul atomului de azot, cu atât va fi mai de bază; adică va deprotonat acizii din mediu mai repede. Dacă amina este foarte simplă, poate chiar fura protonul din alcooli.
Grupurile R contribuie la densitatea electronilor la azot prin efect inductiv; de vreme ce, nu trebuie să uităm că este unul dintre cei mai electronegativi atomi care există. Dacă aceste grupuri sunt foarte lungi sau voluminoase, efectul inductiv va fi mai mare, ceea ce va crește și regiunea negativă din jurul perechii de electroni (··).
Acest lucru face ca (··) să accepte ionul H mai repede+. Cu toate acestea, dacă R sunt foarte voluminoase, elementalitatea scade datorită efectului steric. De ce? Din simplul motiv că H+ trebuie să traverseze o configurație de atomi înainte de a ajunge la azot.
O altă modalitate de a raționa despre basicitatea unei amine este stabilizarea sării sale de amină. Acum, cel care scade prin efect inductiv poate reduce sarcina pozitivă N+, va fi o amină mai de bază. Motivele sunt aceleași tocmai explicate.
Alchilamine vs arilamine
Alchilaminele sunt mult mai bazice decât arilaminele. De ce? Pentru a o înțelege simplu, se arată structura anilinei:
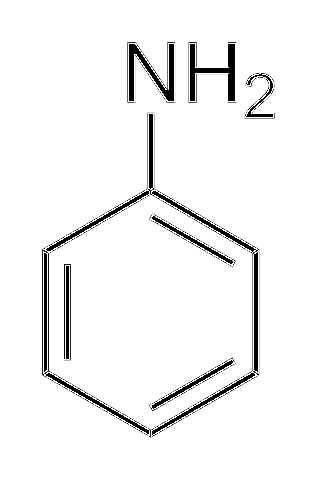
Deasupra, în grupa amino, se află perechea de electroni (··). Această pereche „călătorește” în interiorul inelului în pozițiile orto și para față de NHDouă. Înseamnă că cele două vârfuri superioare și opusul NHDouă sunt încărcate negativ, în timp ce atomul de azot, pozitiv.
Deoarece azotul este încărcat pozitiv, +N, va respinge ionul H+. Și dacă acest lucru nu este suficient, perechea de electroni este delocalizată în interiorul inelului aromatic, făcându-l mai puțin accesibil pentru deprotonarea acizilor..
Basicitatea anilinei poate crește dacă grupurile sau atomii care îi conferă densitate electronică sunt legați de inel, concurând cu perechea (··) și forțând-o să fie localizată cu probabilitate mai mare pe atomul de azot, gata să acționeze ca bază.
Tipuri (primar, secundar, terțiar)

Deși nu este prezentată formal, s-a făcut referire implicit la aminele primare, secundare și terțiare (imaginea de sus, de la stânga la dreapta).
Amine primare (RNHDouă) sunt monosubstituiți; cele secundare (RDouăNH), sunt disubstituite, cu două grupări R alchil sau arii; iar cele terțiare (R3N), sunt trisubstituite și nu au hidrogen.
Toate aminele existente sunt derivate din aceste trei tipuri, astfel încât diversitatea și interacțiunile lor cu matricea biologică și neuronală sunt enorme.
În general, aminele terțiare ar putea fi de așteptat să fie cele mai de bază; Cu toate acestea, o astfel de afirmație nu poate fi făcută fără a cunoaște structurile lui R.
Instruire
Alchilarea amoniacului
La început s-a menționat că aminele sunt derivate din amoniac; prin urmare, cel mai simplu mod de a le forma este prin alchilarea lor. Pentru a face acest lucru, un exces de amoniac reacționează cu o halogenură de alchil, urmată de adăugarea unei baze pentru a neutraliza sarea de amină:
NH3 + RX => RNH3+X- => RNHDouă
Rețineți că acești pași duc la o amină primară. Se pot forma și amine secundare și chiar terțiare, astfel încât randamentul pentru un singur produs scade.
Unele metode de antrenament, cum ar fi sinteza Gabriel, fac posibilă obținerea de amine primare, astfel încât alte produse nedorite să nu se formeze.
De asemenea, cetonele și aldehidele pot fi reduse în prezența amoniacului și a aminelor primare, pentru a da naștere aminelor secundare și terțiare..
Hidrogenarea catalitică
Compușii nitro pot fi reduși în prezența hidrogenului și a unui catalizator la aminele corespunzătoare.
ArNODouă => ArNHDouă
Nitrili, RC≡N și amide, RCONRDouă, sunt, de asemenea, reduse pentru a da amine primare și, respectiv, terțiare.
Nomenclatură
Cum se numesc aminele? De cele mai multe ori sunt denumiți pe baza R, gruparea alchil sau arii. La numele R, derivat din alcanul său, la sfârșit se adaugă cuvântul „amină”.
Astfel, CH3CHDouăCHDouăNHDouă este propilamina. Pe de altă parte, poate fi denumit considerând doar alcanul și nu ca o grupare R: propanamina.
Primul mod de a le denumi este de departe cel mai cunoscut și cel mai folosit.
Când există două grupuri NHDouă, se numește alcanul și sunt listate pozițiile grupurilor amino. Astfel, HDouăNCHDouăCHDouăCHDouăCHDouăNHDouă se numește: 1,4-butanediamină.
Dacă există grupuri oxigenate, cum ar fi OH, ar trebui să i se acorde prioritate față de NHDouă, care se întâmplă să fie numit ca substituent. De exemplu, HOCHDouăCHDouăCHDouăNHDouă Se numește: 3-Aminopropanol.
Și în ceea ce privește aminele secundare și terțiare, literele N sunt utilizate pentru a indica grupele R. Cel mai lung lanț va rămâne cu numele compusului. Astfel cap3NHCHDouăCH3 Se numește: N-metiletilamină.
Aplicații
Coloranți
Aminele aromatice primare pot servi ca materie primă pentru sinteza coloranților azoici. Inițial, aminele reacționează pentru a forma săruri de diazoniu, care formează compuși azoici prin cuplare azoică (sau cuplare diazoică)..
Acestea, datorită colorării lor intense, sunt utilizate în industria textilă ca material de vopsire; de exemplu: metil portocaliu, maro direct 138, galben apus FCF și ponceau.
Droguri și droguri
Multe medicamente funcționează cu agoniști și antagoniști ai neurotransmițătorilor de amine naturale. Exemple:
-Clorofeniramina este un antihistaminic utilizat în controlul proceselor alergice datorate ingerării unor alimente, febrei fânului, mușcăturilor de insecte etc..
-Clorpromazina este un sedativ, nu un agent care induce somnul. Ameliorează anxietatea și este chiar utilizat în tratamentul unor tulburări mentale.
-Efedrina și fenilefedrina sunt utilizate ca decongestionante ale căilor respiratorii.
-Amitriptilina și imipramina sunt amine terțiare care sunt utilizate în tratamentul depresiei. Datorită structurii lor, acestea sunt clasificate ca antidepresive triciclice..
-Analgezicele opioide, cum ar fi morfina, codeline și heroina sunt amine terțiare.
Tratarea gazelor
Mai multe amine, inclusiv diglicolamină (DGA) și dietanolamină (DEA), sunt utilizate în eliminarea dioxidului de carbon (CODouă) și hidrogen sulfurat (HDouăS) prezente în gaze naturale și rafinării.
Chimie agricolă
Metilaminele sunt compuși intermediari în sinteza substanțelor chimice care sunt utilizate în agricultură ca erbicide, fungicide, insecticide și biocide.
Fabricarea rășinii
Metilaminele sunt utilizate în timpul producției de rășini schimbătoare de ioni, utilizabile în deionizarea apei.
Nutrienți pentru animale
Trimetilamina (TMA) este utilizată în principal în producția de clorură de colină, un supliment de vitamina B utilizat în hrana puiilor, curcanilor și porcilor..
Industria cauciucului
Oleatul de dimetilamină (DMA) este un emulgator pentru utilizare în producția de cauciuc sintetic. DMA este utilizat direct ca modificator de polimerizare în faza de vapori a butadienei și ca stabilizator pentru latex de cauciuc natural în locul amoniacului
Solvenți
Dimetilamina (DMA) și monometilamina (MMA) sunt utilizate pentru a sintetiza solvenții polari aprotici dimetilformamidă (DMF), dimetilacetamidă (DMAc) și n-metilpirolidonă (NMP).
Aplicațiile pentru DMF includ: acoperire cu uretan, solvent de fire acrilice, solvenți de reacție și solvenți de extracție.
DMAc este utilizat la fabricarea coloranților pentru fire și a solventului. În cele din urmă, NMP este utilizat la rafinarea uleiurilor lubrifiante, a decapantului de vopsea și a acoperirii cu smalț..
Exemple
Cocaină
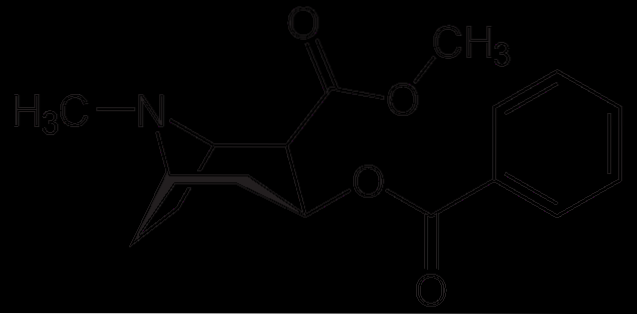
Cocaina este utilizată ca anestezic local în anumite tipuri de intervenții chirurgicale pentru ochi, urechi și gât. După cum s-a văzut, este o amină terțiară.
Nicotină

Nicotina este agentul principal al dependenței de tutun și chimic este o amină terțiară. Nicotina din fumul de tutun se absoarbe rapid și este extrem de toxică.
Morfină
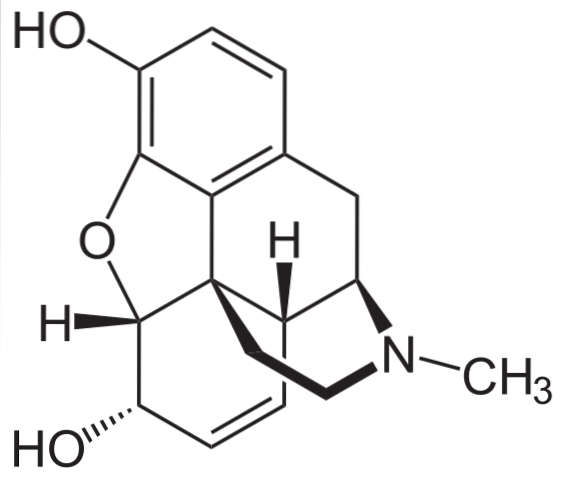
Este una dintre cele mai eficiente analgezice pentru ameliorarea durerii, în special a cancerului. Este, din nou, o amină terțiară.
Serotonina

Serotonina este un neurotransmițător de amină. La pacienții cu depresie, concentrația principalului metabolit al serotoninei este scăzută. Spre deosebire de celelalte amine, aceasta este primară.
Referințe
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (10a ediție.). Wiley plus.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Morrison și Boyd. (1987). Chimie organica. (Ediția a cincea). Addison-Wesley Iberoamericana.
- Compania Chemours. (2018). Metilamine: utilizări și aplicații. Recuperat de pe: chemours.com
- Cercetarea pieței transparenței. (s.f.). Amine: fapte și utilizări importante. Recuperat de la: transparentmarketresearch.com
- Wikipedia. (2019). Amină. Recuperat de pe: en.wikipedia.org
- Ganong, W. F. (2003). Fiziologie medicală. Ediția a 19-a. Editorial Manualul modern.



Nimeni nu a comentat acest articol încă.