
Structura, proprietățile, riscurile și utilizările bicarbonatului de calciu
bicarbonat de calciu este o sare anorganică cu formula chimică Ca (HCO3)Două. Acesta provine din natură din carbonatul de calciu prezent în pietrele de calcar și în mineralele cum ar fi calcitul.
Bicarbonatul de calciu este mai solubil în apă decât carbonatul de calciu. Această caracteristică a permis formarea sistemelor carstice în roci calcaroase și în structurarea peșterilor..

Apa subterană care trece prin fisuri devine saturată în deplasarea sa de dioxid de carbon (CODouă). Aceste ape erodează rocile calcaroase care eliberează carbonat de calciu (CaCO3) care va forma bicarbonatul de calciu, conform următoarei reacții:
Hoţ3(s) + CODouă(g) + HDouăO (l) => Ca (HCO3)Două(aq)
Această reacție are loc în peșteri în care provin ape foarte dure. Bicarbonatul de calciu nu se află într-o stare solidă, ci într-o soluție apoasă, împreună cu Ca.Două+, bicarbonat (HCO3-) și ionul carbonat (CO3Două-).
Ulterior, prin scăderea saturației dioxidului de carbon din apă, are loc reacția inversă, adică transformarea bicarbonatului de calciu în carbonat de calciu:
Ca (HCO3)Două(aq) => CODouă (g) + HDouăO (l) + CaCO3 (s)
Carbonatul de calciu este slab solubil în apă, ceea ce determină precipitarea sa ca solid. Reacția de mai sus este foarte importantă în formarea stalactitelor, stalagmitelor și a altor speleoteme în peșteri..
Aceste structuri stâncoase se formează din picăturile de apă care cad din tavanul peșterilor (imaginea superioară). CaCO3 prezent în picăturile de apă, acesta cristalizează pentru a forma structurile menționate mai sus.
Faptul că bicarbonatul de calciu nu se găsește în stare solidă a îngreunat utilizarea acestuia, fiind găsite câteva exemple. De asemenea, este dificil să găsiți informații despre efectele sale toxice. Există un raport despre un set de efecte secundare de la utilizarea sa ca tratament pentru prevenirea osteoporozei.
Structura
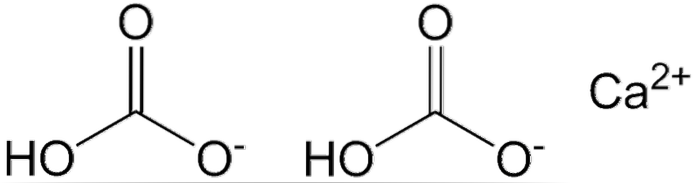
În imaginea de mai sus sunt afișați doi anioni HCO3- și un cation CaDouă+ interacționând electrostatic. Ca.Două+ conform imaginii, ar trebui să fie amplasat în mijloc, deoarece în acest fel HCO3- nu s-ar respinge reciproc din cauza acuzațiilor lor negative.
Sarcina negativă pentru HCO3- delocalizează între doi atomi de oxigen, prin rezonanță între gruparea carbonil C = O și legătura C-O-; în timp ce se afla în CO3Două-, este delocalizat între cei trei atomi de oxigen, deoarece legătura C-OH este deprotonată și, prin urmare, poate primi o sarcină negativă prin rezonanță.
Geometriile acestor ioni pot fi considerate ca sfere de calciu înconjurate de triunghiuri plate de carbonați cu capăt hidrogenat. În ceea ce privește raportul de mărime, calciul este vizibil mai mic decât ionii HCO.3-.
Soluții apoase
Ca (HCO3)Două Nu poate forma solide cristaline și constă de fapt din soluții apoase ale acestei sări. În ele, ionii nu sunt singuri, ca în imagine, ci înconjurați de molecule de HDouăSAU.
Cum interacționează? Fiecare ion este înconjurat de o sferă de hidratare, care va depinde de metal, de polaritate și de structura speciei dizolvate..
Ca.Două+ coordonează cu atomii de oxigen din apă pentru a forma un complex apos, Ca (OHDouă)nDouă+, unde n este în general considerat a fi șase; adică un „octaedru apos” în jurul calciului.
În timp ce anionii HCO3- interacționează fie cu legături de hidrogen (ODouăCO-H-OHDouă) sau cu atomii de hidrogen ai apei în direcția sarcinii negative delocalizate (HOCODouă- H-OH, interacțiune dipol-ion).
Aceste interacțiuni între CaDouă+, HCO3- și apa sunt atât de eficiente încât fac bicarbonatul de calciu foarte solubil în acel solvent; spre deosebire de CaCO3, în care atracțiile electrostatice dintre CaDouă+ și CO3Două- sunt foarte puternice, precipitând din soluția apoasă.
Pe lângă apă, există molecule de CODouă în jur, care reacționează lent pentru a oferi mai mult HCO3- (în funcție de valorile pH-ului).
Solid ipotetic
Până în prezent, dimensiunile și sarcinile ionilor din Ca (HCO3)Două, nici prezența apei, explicați de ce compusul solid nu există; adică cristale pure care pot fi caracterizate prin cristalografie cu raze X. Ca (HCO3)Două nu este altceva decât ioni prezenți în apa din care formările cavernoase continuă să crească.
Da CaDouă+ și HCO3- ar putea fi izolat de apă evitând următoarea reacție chimică:
Ca (HCO3)Două(aq) → CaCO3(s) + CODouă(g) + HDouăO (l)
Acestea ar putea fi apoi grupate într-un solid cristalin alb cu rapoarte stoichiometrice 2: 1 (2HCO3/ 1Ca). Nu există studii despre structura sa, dar ar putea fi comparată cu cea a NaHCO3 (din bicarbonat de magneziu, Mg (HCO3)Două, nu există nici ca solid), nici cu cel al CaCO3.
Stabilitate: NaHCO3 vs Ca (HCO3)Două
NaHCO3 cristalizează în sistemul monoclinic și CaCO3 în sistemele trigonal (calcit) și ortorombic (aragonit). Dacă Na a fost substituit+ de CaDouă+, rețeaua cristalină ar fi destabilizată de diferența mai mare de dimensiuni; adică Na+ fiind mai mic, formează un cristal mai stabil cu HCO3- comparativ cu CaDouă+.
De fapt, Ca (HCO3)Două(aq) are nevoie de apă pentru a se evapora astfel încât ionii săi să se poată grupa într-un cristal; dar rețeaua sa de cristal nu este suficient de puternică pentru a face acest lucru la temperatura camerei. La încălzirea apei are loc reacția de descompunere (ecuația de mai sus).
Fiind ionul Na+ în soluție, ar forma cristalul cu HCO3- înainte de descompunerea sa termică.
Motivul pentru care Ca (HCO3)Două nu cristalizează (teoretic), se datorează diferenței în razele ionice sau dimensiunile ionilor săi, care nu pot forma un cristal stabil înainte de descompunere.
Ca (HCO3)Două vs CaCO3
Dacă, pe de altă parte, H+ la structurile cristaline CaCO3, proprietățile lor fizice s-ar schimba drastic. Poate că punctele lor de topire scad semnificativ și chiar morfologiile cristalelor ajung să fie modificate..
Ar merita să încerci sinteza Ca (HCO3)Două solid? Dificultățile ar putea depăși așteptările, iar o sare cu stabilitate structurală scăzută poate să nu ofere beneficii suplimentare semnificative în nicio aplicație în care alte săruri sunt deja utilizate..
Proprietati fizice si chimice
Formula chimica
Ca (HCO3)Două
Greutate moleculară
162,11 g / mol
Starea fizică
Nu vine într-o stare solidă. Se găsește într-o soluție apoasă și încercările de a o transforma într-un solid prin evaporarea apei nu au avut succes, deoarece devine carbonat de calciu.
Solubilitatea apei
16,1 g / 100 ml la 0 ° C; 16,6 g / 100 ml la 20 ° C și 18,4 g / 100 ml la 100 ° C. Aceste valori indică o afinitate ridicată a moleculelor de apă pentru ionii de Ca (HCO3)Două, după cum sa explicat în secțiunea anterioară. Între timp, doar 15 mg de CaCO3 se dizolvă într-un litru de apă, reflectând interacțiunile lor electrostatice puternice.
Deoarece Ca (HCO3)Două nu poate forma un solid, solubilitatea sa nu poate fi determinată experimental. Cu toate acestea, având în vedere condițiile create de CODouă dizolvat în apa din jurul calcarului, s-ar putea calcula masa de calciu dizolvată la temperatura T; masă, care ar fi egală cu concentrația de Ca (HCO3)Două.
La diferite temperaturi, masa dizolvată crește așa cum se arată prin valorile de la 0, 20 și 100 ° C. Apoi, conform acestor experimente, se determină cât de mult din Ca (HCO3)Două se dizolvă în vecinătatea CaCO3 într-un mediu apos aerat cu CODouă. Odată ce CO scapăDouă gazos, CaCO3 va precipita, dar nu Ca (HCO3)Două.
Puncte de topire și fierbere
Rețeaua cristalină a Ca (HCO3)Două este mult mai slab decât CaCO3. Dacă poate fi obținut în stare solidă, iar temperatura la care se topește este măsurată într-un fusiometru, cu siguranță s-ar obține o valoare cu mult sub 899 ° C. În mod similar, același lucru ar fi de așteptat la determinarea punctului de fierbere..
Punct de ardere
Nu combustibil.
Riscuri
Deoarece acest compus nu există în formă solidă, este puțin probabil ca manipularea soluțiilor sale apoase să prezinte un risc, deoarece ambii ioni de CaDouă+ ca HCO3- nu sunt nocive la concentrații scăzute; și, prin urmare, riscul mai mare care ar fi ingerarea acestor soluții, ar putea fi cauzat doar de o doză periculoasă de calciu ingerată.
Dacă compusul ar forma un solid, deși poate diferit fizic de CaCO3, efectele sale toxice nu pot depăși simplul disconfort și uscăciune după contact fizic sau inhalare.
Aplicații
-Soluțiile de bicarbonat de calciu au fost folosite de mult timp pentru spălarea hârtiei vechi, în special a operelor de artă sau a documentelor importante din punct de vedere istoric..
-Utilizarea soluțiilor de bicarbonat este utilă, nu numai pentru că neutralizează acizii din hârtie, dar oferă și o rezervă alcalină de carbonat de calciu. Ultimul compus oferă protecție pentru deteriorarea viitoare a hârtiei..
-La fel ca alte bicarbonate, este utilizat în drojdii chimice și în formulări efervescente de tablete sau pulbere. În plus, bicarbonatul de calciu este utilizat ca aditiv alimentar (soluții apoase ale acestei sări).
-Soluțiile de bicarbonat au fost utilizate în prevenirea osteoporozei. Cu toate acestea, într-un caz au fost observate efecte secundare, cum ar fi hipercalcemia, alcaloza metabolică și insuficiența renală..
-Bicarbonatul de calciu este administrat ocazional intravenos pentru a corecta efectul depresiv al hipokaliemiei asupra funcției cardiace.
-Și, în cele din urmă, asigură calciu organismului, care este un mediator al contracției musculare, în același timp în care corectează acidozele care pot apărea într-o stare hipokalemică..
Referințe
- Wikipedia. (2018). Bicarbonat de calciu. Luat de pe: en.wikipedia.org
- Sirah Dubois. (03 octombrie 2017). Ce este bicarbonatul de calciu? Recuperat de pe: livestrong.com
- Centrul de învățare a științei. (2018). Chimia carbonatului. Recuperat de pe: sciencelearn.org.nz
- PubChem. (2018). Bicarbonat de calciu. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Amy E. Gerbracht și Irene Brückle. (1997). Utilizarea soluțiilor de bicarbonat de calciu și bicarbonat de magneziu în ateliere de conservare mici: rezultatele sondajului. Recuperat de la: cool.conservation-us.org



Nimeni nu a comentat acest articol încă.