
Structura, proprietățile și utilizările bromurii de sodiu (NaBr)
bromură de sodiu este o specie chimică care aparține sărurilor de origine anorganică. Structura sa este compusă din brom halogen și elementul metalic sodiu într-un raport 1: 1. Formula sa chimică este NaBr și se află într-o stare solidă de agregare în condiții standard de temperatură și presiune (25 ° C și 1 atm).
În mod normal, poate fi văzut ca o pulbere albă și este considerat un compus de tip cristalin care prezintă, de asemenea, un comportament higroscopic; adică are capacitatea de a absorbi umezeala din împrejurimile sale.

În mod similar, bromura de sodiu are caracteristici fizice foarte asemănătoare cu un alt compus ionic din același metal: clorura de sodiu. Această clorură este reprezentată ca NaCl, care este mai frecvent cunoscută sub numele de sare obișnuită sau sare de masă..
Are un număr mare de utilizări în diferite domenii ale științei; De exemplu, este utilizat în producerea diferitelor tipuri de medicamente (sedative, hipnotice, anticonvulsivante, printre altele), precum și în sinteze organice și chiar în aplicații de fotografie..
Indice articol
- 1 Structura chimică
- 1.1 Sinteza chimică
- 2 Proprietăți
- 3 utilizări
- 4 Referințe
Structura chimică
După cum sa menționat anterior, bromura de sodiu apare în faza solidă și, ca multe alte săruri de natură anorganică, are o conformație structurală cristalină..
Această moleculă cristalină, formată dintr-un brom și un atom de hidrogen, are o conformație de tip cub centrat pe față, cum ar fi sărurile de tip halogenură ale aceluiași metal (NaI, NaF și NaCl).
Acest aranjament molecular formează baza structurală a multor compuși, în care ordonarea este realizată în așa fel încât fiecare ion să rămână în centrul unei figuri octaedrice, așa cum se arată în imaginea următoare.
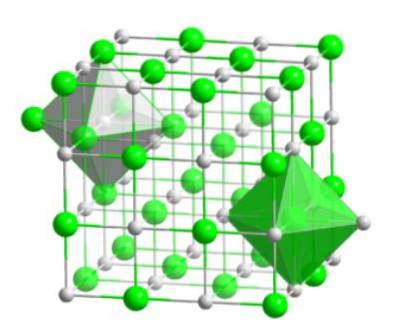
În acest tip de cristal se poate observa cum fiecare dintre ioni are în jurul său alți șase ioni - care au o sarcină electrică opusă - care se află la capetele figurii octaedrice..
La fel, structura acestei substanțe ionice implică faptul că are un punct de topire ridicat de aproximativ 747 ° C, fiind găsită comercial sub cele două forme: o specie anhidră (fără molecule de apă) și o specie dihidratată (cu două molecule de apă în structura sa formula (NaBr 2HDouăO)), ale căror puncte de topire sunt diferite.
Sinteza chimică
Bromura de sodiu provine din reacția chimică care apare între bromura de hidrogen (BrH, o halogenură de hidrogen în faza gazoasă) și hidroxidul de sodiu (NaOH, o bază puternică în faza solidă și cu proprietăți higroscopice).
În acest fel este fabricat comercial, prin adăugarea unui exces de brom la o soluție de NaOH. Astfel se formează un amestec de bromură / brom. Ulterior, produsele rezultate sunt supuse evaporării până la uscare și sunt tratate cu carbon pentru a genera reacția de reducere a ionului bromat (BrO3-) la ionul bromură (Br-).
Neutralizare
În mod similar, această sare anorganică poate fi produsă și printr-o reacție de neutralizare a carbonatului de sodiu (NaDouăCO3) cu acid bromic (HBrO3), urmând aceeași procedură descrisă mai sus.
Printr-o sinteză este posibilă producerea acestei substanțe prin reacția dintre fierul cu brom și apă. Ca produs al acestei reacții, provine specia de bromură feros-ferică.
Mai târziu, această specie s-a format (reprezentată ca FeBrDouă/ FeBr3) se dizolvă în apă și i se adaugă o anumită cantitate de carbonat de sodiu. În cele din urmă, soluția este filtrată și trece printr-un proces de evaporare pentru a obține în final bromura de sodiu..
Proprietăți
- Se găsește în mod obișnuit într-o stare solidă de agregare, sub formă de pulbere albă.
- Are o structură cristalină, cu un aranjament molecular în formă de cub centrat pe fețe.
- Punctul de topire al acestei substanțe este de aproximativ 747 ° C pentru forma sa anhidră și 36 ° C pentru forma sa dihidrată, prezentând descompunerea înainte de topire..
- Este alcătuit dintr-un ion de sodiu (Na+) și un ion bromură (Br-), cu o masă molară sau o greutate moleculară de 102,89 g / mol.
- Punctul său de fierbere este destul de ridicat, observat la 1390 ° C (echivalentul a 2530 ° F sau 1660 K).
- Solubilitatea acestei specii este de aproximativ 94,32 g / 100ml în apă la 25 ° C, crescând odată cu creșterea temperaturii..
- Când este încălzită până la punctul în care se descompune, această substanță degajă gaze de brom și oxid de sodiu care sunt considerate toxice..
- Densitatea formei anhidre a bromurii de sodiu este de 3,21 g / cm3, în timp ce cel al compusului dihidrat este de 2,18 g / cm3.
- Solubilitatea sa în alcool este considerată moderată, ca și în alți solvenți, cum ar fi piridina, amoniacul și hidrazina.
- Prezintă insolubilitate împotriva acetonitrilului și acetonei.
Aplicații
- În medicină este utilizat ca medicament pentru un număr mare de afecțiuni care provoacă convulsii și ca terapie pentru prevenirea epilepsiei la pacienții cu sindrom Wolf-Hirschhorn, precum și în tratamente sedative și hipnotice..
- În medicina veterinară se utilizează la câinii care prezintă tulburări convulsive din cauza efectelor secundare ale medicamentelor precum primidona sau fenobarbitalul.
- În domeniul industriei petroliere, este utilizat în procesele de preparare a anumitor fluide de densitate variabilă care sunt utilizate în puțurile de petrol..
- În domeniul cercetării biologice, proprietățile sale microbiocide au fost dovedite; adică este folosit pentru a controla dezvoltarea diferitelor tipuri de bacterii.
- În anumite sinteze de tip organic, această sare anorganică este utilizată pentru prepararea altor specii constând din brom. De exemplu, prin intermediul reacției Finkelstein se obțin anumite halogenuri de alchil cu reactivitate mai mare, dintre care una a fost folosită pe scară largă în fotografie..
- În zona de curățare și dezinfectare, bromura de sodiu este utilizată în combinație cu clor pentru igienizarea volumelor mari de apă, cum ar fi în piscine și căzi cu hidromasaj..
Referințe
- Wikipedia. (s.f.). Bromură de sodiu. Recuperat de pe en.wikipedia.org
- PubChem. (s.f.). Bromură de sodiu. Adus de la pubchem.ncbi.nlm.nih.gov
- Johnson, A. W. (1999). Invitație la chimia organică. Recuperat de pe books.google.co.ve
- Știință directă. (s.f.). Bromură de sodiu. Adus de la sciencedirect.com
- Riviere, J. E. și Papich, M. G. (2009). Farmacologie și terapeutică veterinară. Recuperat de pe books.google.co.ve



Nimeni nu a comentat acest articol încă.