
Caracteristici, tipuri și exemple de carbon primare
carbon primar Este unul care, în orice compus, indiferent de mediul său molecular, formează o legătură cu cel puțin un alt atom de carbon. Această legătură poate fi simplă, dublă (=) sau triplă (≡), atâta timp cât există doar doi atomi de carbon legați și în poziții adiacente (logic).
Hidrogenii prezenți pe acest carbon se numesc hidrogeni primari. Cu toate acestea, caracteristicile chimice ale hidrogenilor primari, secundari și terțiari diferă puțin și sunt predominant supuse mediilor moleculare ale carbonului. Din acest motiv, carbonul primar (1 °) este de obicei tratat cu mai multă importanță decât hidrogenii săi.
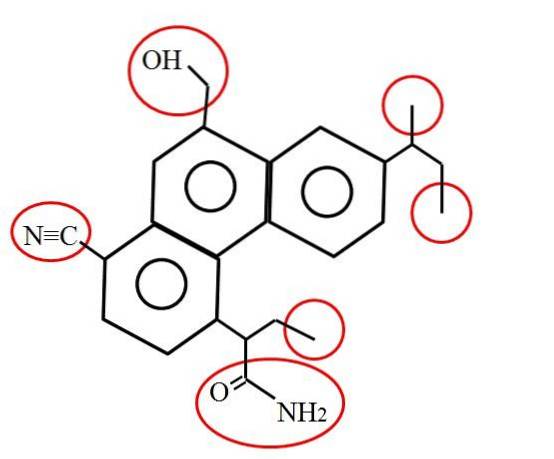
Și cum arată un carbon primar? Răspunsul depinde, după cum sa menționat, de mediul dvs. molecular sau chimic. De exemplu, imaginea de mai sus indică carbonii primari, închiși în cercuri roșii, în structura unei molecule ipotetice (deși probabil reale)..
Dacă priviți cu atenție, veți descoperi că trei dintre ele sunt identice; în timp ce celelalte trei sunt total diferite. Primele trei constau din grupări metil, -CH3 (în dreapta moleculei), iar celelalte sunt grupările metilol, -CHDouăOH, nitril, -CN și o amidă, RCONHDouă (în stânga moleculei și sub ea).
Indice articol
- 1 Caracteristicile carbonului primar
- 1.1 Locație și legături
- 1.2 Impediment steric scăzut
- 1.3 Reactivitate
- 2 tipuri
- 3 Exemple
- 3.1 Aldehidele și acizii carboxilici
- 3.2 La aminele liniare
- 3.3 În halogenuri de alchil
- 4 Referințe
Caracteristicile carbonului primar
Locație și linkuri
Șase carboni primari au fost arătați mai sus, fără alte comentarii decât locațiile lor și ce alți atomi sau grupuri îi însoțesc. Pot fi oriunde în structură și, oriunde s-ar afla, marchează „sfârșitul drumului”; adică acolo unde se termină o secțiune a scheletului. Acesta este motivul pentru care uneori sunt denumiți carboni terminali..
Astfel, este evident că grupurile -CH3 sunt terminale și carbonul lor este de 1 °. Rețineți că acest carbon se leagă de trei hidrogeni (care au fost omiși în imagine) și de un singur carbon, completând respectivele patru legături..
Prin urmare, toate sunt caracterizate prin faptul că au o legătură C-C, o legătură care poate fi și dublă (C = CHDouă) sau triplu (C≡CH). Acest lucru rămâne adevărat chiar dacă există alți atomi sau grupuri atașate acestor carboni; la fel ca și cu ceilalți trei atomi de carbon rămași de 1 ° din imagine.
Impediment steric scăzut
S-a menționat că carbonii primari sunt terminali. Semnalând sfârșitul unei întinderi a scheletului, niciun alt atom nu interferează spațial cu ele. De exemplu, grupurile -CH3 pot interacționa cu atomii altor molecule; dar interacțiunile lor cu atomii vecini ai aceleiași molecule sunt scăzute. Același lucru este valabil și pentru -CHDouăOH și -CN.
Acest lucru se datorează faptului că sunt practic expuși la „vid”. Prin urmare, acestea prezintă în general o piedică sterică scăzută în raport cu celelalte tipuri de carbon (al 2-lea, al 3-lea și al 4-lea).
Cu toate acestea, există excepții, produsul unei structuri moleculare cu prea mulți substituenți, flexibilitate ridicată sau tendința de a se închide în sine..
Reactivitate
Una dintre consecințele obstacolului steric inferior în jurul primului carbon este o expunere mai mare la reacția cu alte molecule. Cu cât mai puțini atomi obstrucționează calea moleculei atacante către aceasta, cu atât va fi mai probabilă reacția sa..
Dar acest lucru este adevărat doar din punct de vedere steric. De fapt, cel mai important factor este cel electronic; adică care este mediul carbonilor menționați 1 °.
Carbonul adiacent celui primar îi transferă o parte din densitatea electronică; și același lucru se poate întâmpla în direcția opusă, favorizând un anumit tip de reacție chimică.
Astfel, factorii sterici și electronici explică de ce este de obicei cel mai reactiv; deși, nu există cu adevărat o regulă de reactivitate globală pentru toți carbonii primari.
Tipuri
Carbonilor primari le lipsește o clasificare intrinsecă. În schimb, acestea sunt clasificate pe baza grupurilor de atomi de care aparțin sau de care sunt legați; Acestea sunt grupurile funcționale. Și deoarece fiecare grupă funcțională definește un anumit tip de compus organic, există diferiți atomi de carbon primari.
De exemplu, grupul -CHDouăOH este derivat din alcoolul primar RCHDouăOH. Alcoolii primari constau deci din 1 ° carboni legați de gruparea hidroxil, -OH.
Grupul nitril, -CN sau -C≡N, pe de altă parte, poate fi atașat direct la un atom de carbon numai prin legătura C-CN simplă. Astfel, existența nitrililor secundari (RDouăCN) sau mult mai puțin terțiar (R3CN).
Un caz similar se întâmplă cu substituentul derivat din amidă, -CONHDouă. Poate suferi substituții ale hidrogenilor atomului de azot; dar carbonul său se poate lega doar de un alt carbon și, prin urmare, va fi considerat întotdeauna ca primar, C-CONHDouă.
Și în ceea ce privește grupul -CH3, Este un substitut alchil care se poate lega doar de un alt carbon, fiind deci primar. Dacă grupul etil este luat în considerare, -CHDouăCH3, se va observa imediat că CHDouă, grupa metilen, este un carbon de 2 °, deoarece este legat de doi atomi de carbon (C-CHDouăCH3).
Exemple
Aldehidele și acizii carboxilici
S-au menționat câteva exemple de carboni primari. Pe lângă acestea, există următoarea pereche de grupuri: -CHO și -COOH, numite formil și, respectiv, carboxil. Carbonii acestor două grupuri sunt primari, deoarece vor forma întotdeauna compuși cu formulele RCHO (aldehide) și RCOOH (acizi carboxilici).
Această pereche este strâns legată una de cealaltă datorită reacțiilor de oxidare pe care le suferă gruparea formil pentru a se transforma în carboxil:
RCHO => RCOOH
Reacția suferită de aldehide sau gruparea -CHO dacă este ca substituent într-o moleculă.
În aminele liniare
Clasificarea aminelor depinde exclusiv de gradul de substituție a hidrogenilor din grupa -NHDouă. Cu toate acestea, în aminele liniare se pot observa carboni primari, ca și în propanamină:
CH3-CHDouă-CHDouă-NHDouă
Rețineți că CH3 va fi întotdeauna primul carbon, dar de data aceasta CHDouă în dreapta este, de asemenea, 1 °, deoarece este legat de un singur carbon și de grupul NHDouă.
În halogenuri de alchil
Un exemplu foarte similar cu precedentul este dat cu halogenurile de alchil (și în mulți alți compuși organici). Să presupunem că bromopropanul:
CH3-CHDouă-CHDouă-Fr
În ea carbonii primari rămân aceiași.
Ca o concluzie, carbonii de 1 ° transcend tipul de compus organic (și chiar organometalic), deoarece pot fi prezenți în oricare dintre ei și sunt identificați pur și simplu deoarece sunt legați de un singur carbon.
Referințe
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (10a ediție.). Wiley plus.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Morrison, R. T. și Boyd, R. N. (1987). Chimie organica. (5ta Ediție). Editorial Addison-Wesley Interamericana.
- Ashenhurst J. (16 iunie 2010). Primar, secundar, terțiar, cuaternar în chimia organică. Master Chimie Organică. Recuperat de pe: masterorganicchemistry.com
- Wikipedia. (2019). Carbon primar. Recuperat de pe: en.wikipedia.org


Nimeni nu a comentat acest articol încă.