
Structura, proprietățile, sinteza și utilizările ciclohexenei
ciclohexen este o alchenă ciclică sau olefină a cărei formulă moleculară este C6H10. Se compune dintr-un lichid incolor, insolubil în apă și miscibil cu mulți solvenți organici. Se caracterizează prin faptul că este inflamabil, iar în natură se găsește de obicei în gudronul de cărbune.
Ciclohexena este sintetizată prin hidrogenarea parțială a benzenului și prin deshidratarea alcoolului ciclohexanol; adică o formă mai oxidată. La fel ca alte cicloalcene, suferă reacții electrofile și de adăugare a radicalilor liberi; de exemplu, reacția de halogenare.

Această alchenă ciclică (imaginea superioară) formează amestecuri azeotrope (care nu se separă prin distilare), cu alcooli inferiori și acid acetic. Nu este foarte stabil în depozitarea prelungită, deoarece se descompune sub acțiunea soarelui și a radiațiilor ultraviolete.
Ciclohexena este utilizată ca solvent și, prin urmare, are numeroase aplicații, cum ar fi: stabilizator de benzină cu octanie mare și pentru extracția uleiurilor.
Dar cel mai important lucru este că ciclohexena servește ca materie intermediară și primă pentru obținerea a numeroși compuși extrem de utili, inclusiv: ciclohexanonă, acid adipic, acid maleic, ciclohexan, butadienă, acid ciclohexilcarboxilic etc..
Indice articol
- 1 Structura ciclohexenei
- 1.1 Interacțiuni intermoleculare
- 2 Proprietăți
- 2.1 Denumiri chimice
- 2.2 Greutate moleculară
- 2.3 Aspect fizic
- 2.4 Miros
- 2.5 Punctul de fierbere
- 2.6 Punct de topire
- 2.7 Punct de aprindere
- 2.8 Solubilitatea în apă
- 2.9 Solubilitate în solvenți organici
- 2.10 Densitate
- 2.11 Densitatea vaporilor
- 2.12 Presiunea vaporilor
- 2.13 Autoaprindere
- 2.14 Descompunerea
- 2.15 Vâscozitatea
- 2.16 Căldura de ardere
- 2.17 Căldura de vaporizare
- 2.18 Tensiunea superficială
- 2.19 Polimerizare
- 2.20 Pragul mirosului
- 2.21 Indicele de refracție
- 2,22 pH
- 2.23 Stabilitate
- 2.24 Reacții
- 3 Sinteza
- 4 utilizări
- 5 Riscuri
- 6 Referințe
Structura ciclohexenei
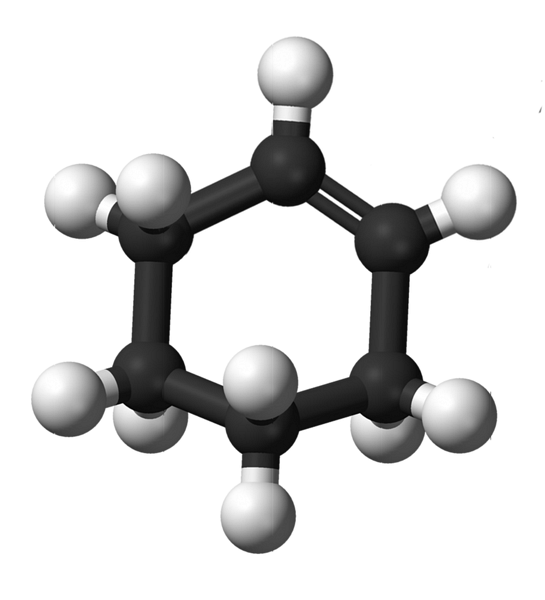
Imaginea superioară arată structura ciclohexenei cu un model de sfere și bare. Rețineți inelul cu șase carbon și dubla legătură, ambele nesaturări ale compusului. Din această perspectivă, se pare că inelul este plat; dar nu este deloc.
Pentru început, carbonii legăturii duble au hibridizare spDouă, ceea ce le conferă o geometrie plană trigonală. Prin urmare, acești doi atomi de carbon și cei adiacenți lor, se află în același plan; în timp ce cei doi carboni de la capătul opus (la dubla legătură), sunt deasupra și sub planul menționat.
Imaginea de mai jos ilustrează perfect ceea ce tocmai a fost explicat.

Rețineți că banda neagră este compusă din patru atomi de carbon: cei doi ai legăturii duble, iar ceilalți adiacenți acestora. Perspectiva expusă este cea care ar fi obținută dacă un spectator ar plasa ochiul direct în fața dublei legături. Se poate vedea apoi că un carbon este deasupra și sub acest plan.
Deoarece molecula de ciclohexen nu este statică, cei doi carboni se vor schimba: unul va coborî în timp ce celălalt va urca deasupra planului. Deci, te-ai aștepta ca acea moleculă să se comporte.
Interacțiuni intermoleculare
Ciclohexena este o hidrocarbură și, prin urmare, interacțiunile sale intermoleculare se bazează pe forțele de dispersie din Londra.
Acest lucru se datorează faptului că molecula este apolară, fără moment dipolar permanent, iar greutatea sa moleculară este factorul care contribuie cel mai mult la menținerea coeziunii sale în lichid..
De asemenea, legătura dublă crește gradul de interacțiune, deoarece nu se poate mișca cu aceeași flexibilitate ca și a celorlalți atomi de carbon și acest lucru favorizează interacțiunea dintre moleculele vecine. Din acest motiv, ciclohexanul are un punct de fierbere ușor mai mare (83 ° C) decât cel al ciclohexanului (81 ° C)..
Proprietăți
Denumiri chimice
Ciclohexen, tetrahidrobenzen.
Greutate moleculară
82,146 g / mol.
Aspectul fizic
Lichid incolor.
Miros
Miros dulce.
Punct de fierbere
83 ° C la 760 mmHg.
Punct de topire
-103,5 ºC.
punctul de aprindere
-7 ºC (cupă închisă).
Solubilitatea apei
Practic insolubil (213 mg / L).
Solubilitate în solvenți organici
Miscibil cu etanol, benzen, tetraclorură de carbon, eter de petrol și acetonă. Este de așteptat că este capabil să dizolve compuși apolari, cum ar fi unii dintre alotropii carbonului..
Densitate
0,810 g / cm3 la 20ºC.
Densitatea vaporilor
2,8 (relativ la aer luat ca egal cu 1).
Presiunea de vapori
89 mmHg la 25 ° C.
Autoaprindere
244 ºC.
Descompunere
Se descompune în prezența sărurilor de uraniu, sub acțiunea razelor solare și a radiațiilor ultraviolete.
Viscozitate
0,625 mPascal la 25 ° C.
Căldura de ardere
3.751,7 kJ / mol la 25 ° C.
Căldura de vaporizare
30,46 kJ / mol la 25 ° C.
Tensiune de suprafata
26,26 mN / m.
Polimerizare
Poate polimeriza în anumite condiții.
Pragul mirosului
0,6 mg / m3.
Indicele de refracție
1,4465 la 20 ° C.
pH
7-8 la 20ºC.
Stabilitate
Ciclohexenul nu este foarte stabil în timpul depozitării pe termen lung. Expunerea la lumină și aer poate duce la producerea de peroxizi. De asemenea, este incompatibil cu agenți oxidanți puternici..
Reacții
-Cicloalcenii suferă în principal reacții de adiție, atât electrofile, cât și cu radicali liberi.
-Reacționează cu brom pentru a forma 1,2-dibromociclohexan.
-Se oxidează rapid în prezența permanganatului de potasiu (KMnO4).
-Este capabil să producă un epoxid (ciclohexen oxid) în prezența acidului peroxibenzoic.
Sinteză
Ciclohexenul este produs prin cataliza acidă a ciclohexanolului:
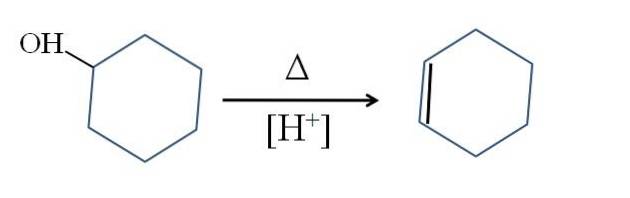
Simbolul Δ reprezintă căldura necesară pentru a promova ieșirea grupului OH ca moleculă de apă într-un mediu acid (-OHDouă+).
Ciclohexenul este produs și prin hidrogenarea parțială a benzenului; adică două dintre legăturile sale duble adaugă o moleculă de hidrogen:
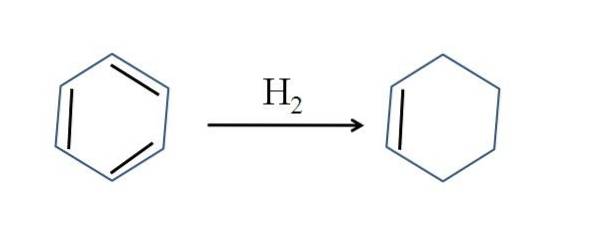
Deși reacția pare simplă, necesită presiuni mari de HDouă și catalizatori.
Aplicații
-Are utilitate ca solvent organic. Mai mult, este o materie primă pentru producerea de acid adipic, aldehidă adipică, acid maleic, ciclohexan și acid ciclohexilcarboxilic..
-Este utilizat în producția de clorură de ciclohexan, un compus utilizat ca intermediar în fabricarea produselor farmaceutice și a aditivului pentru cauciuc.
-Ciclohexena este utilizată și în sinteza ciclohexanonei, materie primă pentru producerea de medicamente, pesticide, parfumuri și coloranți..
-Ciclohexenul este implicat în sinteza aminociclohexanolului, un compus care este utilizat ca agent tensioactiv și emulgator.
-Mai mult, ciclohexena poate fi utilizată pentru prepararea în laborator a butadienei. Ultimul compus este utilizat la fabricarea cauciucului sintetic, la fabricarea anvelopelor pentru automobile și este utilizat și la fabricarea materialelor plastice acrilice..
-Ciclohexenul este o materie primă pentru sinteza lizinei, fenolului, rășinii policicloolefinice și a aditivilor din cauciuc.
-Este folosit ca stabilizator pentru benzina cu octanie mare.
-Intervine în sinteza acoperirilor impermeabile, a filmelor rezistente la fisuri și a lianților de lipire pentru acoperiri.
Riscuri
Ciclohexenul nu este un compus foarte toxic, dar poate provoca roșeață a pielii și a ochilor la contact. Inhalarea poate provoca tuse și somnolență. În plus, ingestia acestuia poate provoca somnolență, dificultăți de respirație și greață..
Ciclohexenul este slab absorbit din tractul gastro-intestinal, prin urmare nu sunt de așteptat efecte sistemice grave de la ingestie. Complicația maximă este aspirația sa prin sistemul respirator, care poate provoca pneumonie chimică.
Referințe
- Joseph F. Chiang și Simon Harvey Bauer. (1968). Structura moleculară a ciclohexenei. J. Am. Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Ciclohexen: Pericole, sinteză și structură. Studiu. Recuperat de la: study.com
- Morrison, R. T. și Boyd, R. N. (1987). Chimie organica. (5ta Ediție.). Editorial Addison-Wesley Iberoamericana.
- PubChem. (2019). Ciclohexen. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Carte chimică. (2019). Ciclohexen. Recuperat de pe: chemicalbook.com
- Rețea de date privind toxicologia. (2017). Ciclohexen. Toxnet. Recuperat de la: toxnet.nlm.nih.gov
- Chimioxi. (s.f.). Formula structurală pentru ciclohexenă este. Recuperat de pe: chemoxy.com



Nimeni nu a comentat acest articol încă.