
Structura acidului benzoic, proprietăți, producție, utilizări
acid benzoic este cel mai simplu acid aromatic dintre toate, având ca formulă moleculară C6H5COOH. Își datorează numele faptului că avea de mult timp benzoina ca sursă principală, o rășină obținută din coaja mai multor copaci din genul Styrax..
Se găsește în multe plante, în special în fructe, precum caisele și afinele. De asemenea, este produs în bacterii ca produs secundar al metabolismului aminoacidului fenilalanină. De asemenea, este generat în intestin prin procesarea bacteriană (oxidativă) a polifenolilor prezenți în unele alimente..

După cum se poate vedea în imaginea de mai sus, C6H5COOH este, spre deosebire de mulți acizi, un compus solid. Solidul său este format din cristale ușoare, albe și filiforme, care emit o aromă de migdale.
Aceste ace sunt cunoscute încă din secolul al XVI-lea; de exemplu, Nostradamus în 1556 descrie distilarea sa uscată din guma benzoină.
Una dintre principalele capacități ale acidului benzoic este de a inhiba creșterea drojdiei, mucegaiului și a unor bacterii; pentru care este folosit ca conservant alimentar. Această acțiune este dependentă de pH.
Acidul benzoic are mai multe acțiuni medicinale, fiind utilizat ca o componentă a produselor farmaceutice care sunt utilizate în tratamentul bolilor de piele, cum ar fi pecingine și piciorul de atlet. Este, de asemenea, utilizat ca un inhalant decongestionant, expectorant și calmant al durerii.
O mare proporție de acid benzoic produs industrial este destinată producției de fenol. De asemenea, o parte din aceasta este destinată producției de benzoați de glicol, utilizați la fabricarea plastifianților..
Deși acidul benzoic nu este un compus deosebit de toxic, acesta are unele acțiuni nocive pentru sănătate. Din acest motiv, OMS recomandă o doză maximă de aport de 5 mg / kg de greutate corporală / zi, care este echivalentă cu un aport zilnic de 300 mg de acid benzoic..
Indice articol
- 1 Structura acidului benzoic
- 1.1 Legături de cristal și hidrogen
- 2 Proprietăți fizice și chimice
- 2.1 Denumiri chimice
- 2.2 Formula moleculară
- 2.3 Greutate moleculară
- 2.4 Descrierea fizică
- 2.5 Miros
- 2.6 Aromă
- 2.7 Punctul de fierbere
- 2.8 Punct de topire
- 2.9 Punct de aprindere
- 2.10 Sublimarea
- 2.11 Solubilitate în apă
- 2.12 Solubilitate în solvenți organici
- 2.13 Densitatea
- 2.14 Densitatea vaporilor
- 2.15 Presiunea vaporilor
- 2.16 Stabilitate
- 2.17 Descompunerea
- 2.18 Vâscozitatea
- 2.19 Căldura de ardere
- 2.20 Căldura de vaporizare
- 2,21 pH
- 2.22 Tensiunea superficială
- 2,23 pKa
- 2.24 Indicele de refracție
- 2.25 Reacții
- 3 Producție
- 4 utilizări
- 4.1 Industrial
- 4.2 Medicamentos
- 4.3 Conservarea alimentelor
- 4.4 Altele
- 5 Toxicitate
- 6 Referințe
Structura acidului benzoic
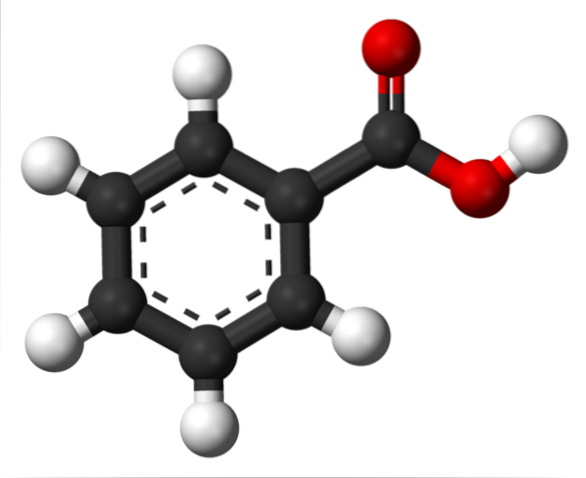
În imaginea superioară structura acidului benzoic este reprezentată cu un model de bare și sfere. Dacă se numără numărul de sfere negre, se va verifica dacă există șase dintre ele, adică șase atomi de carbon; două sfere roșii corespund celor doi atomi de oxigen ai grupului carboxil, -COOH; și în cele din urmă, sferele albe sunt atomii de hidrogen.
După cum se poate vedea, în stânga este inelul aromatic, a cărui aromaticitate este ilustrată de liniile întrerupte din centrul inelului. Și în dreapta, grupul -COOH, responsabil pentru proprietățile acide ale acestui compus.
Molecular, C6H5COOH are o structură plană, datorită faptului că toți atomii săi (cu excepția hidrogenilor) au hibridizare spDouă.
Pe de altă parte, grupul -COOH extrem de polar permite existența unui dipol permanent în structură; dipol care ar putea fi văzut la prima vedere dacă ar fi disponibilă harta sa de potențial electrostatic.
Acest fapt are drept consecință că C6H5COOH poate interacționa cu el însuși prin forțe dipol-dipol; în mod specific, cu legăturile speciale de hidrogen.
Dacă vă uitați la grupul -COOH, veți descoperi că oxigenul din C = O poate accepta o legătură de hidrogen; în timp ce oxigenul O-H, le donează.
Legături de cristal și hidrogen
Acidul benzoic poate forma două legături de hidrogen: primește și acceptă una simultan. Prin urmare, formează dimeri; adică molecula sa este „legată” de alta.
Sunt aceste perechi sau dimeri, C6H5COOH-HOOCC6H5, baza structurală care definește solidul rezultat din dispunerea sa în spațiu.
Acești dimeri compun un plan de molecule care, date fiind interacțiunile lor puternice și direcționale, reușesc să stabilească un model ordonat în solid. Inelele aromatice participă, de asemenea, la această ordonare prin interacțiuni prin forțe de dispersie..
Ca rezultat, moleculele construiesc un cristal monoclinic, ale cărui caracteristici structurale exacte pot fi studiate prin tehnici instrumentale, cum ar fi difracția cu raze X..
De aici, atunci, o pereche de molecule plate poate fi aranjată în spațiu, predominant prin legarea hidrogenului, pentru a da naștere acelor acuri albe și cristaline..
Proprietati fizice si chimice
Denumiri chimice
Acid:
-benzoic
-benzen carboxilic
-dracilic
-carboxibenzen
-benzenoform
Formulă moleculară
C7H6SAUDouă sau C6H5COOH.
Greutate moleculară
122,123 g / mol.
Descriere Fizica
Solid sau sub formă de cristale, de obicei de culoare albă, dar poate avea culoarea bej dacă prezintă anumite impurități. Cristalele sale sunt solzoase sau în formă de ac (vezi prima imagine).
Miros
Miroase a migdale și este plăcut.
Gust
Insipid sau ușor amar. Limita de detectare a aromei este de 85 ppm.
Punct de fierbere
480ºF la 760mmHg (249ºC).
Punct de topire
252,3 º F (121,5 - 123,5 ºC).
punctul de aprindere
250ºF (121ºC).
Sublimarea
Se poate sublima de la 100 ° C.
Solubilitatea apei
3,4 g / L la 25 ° C.
Solubilitate în solvenți organici
-1 g de acid benzoic se dizolvă într-un volum egal cu: 2,3 ml alcool rece; 4,5 ml cloroform; 3 ml eter; 3 ml de acetonă; 30 ml de tetraclorură de carbon; 10 ml benzen; 30 ml disulfură de carbon; și 2,3 ml ulei de terebentină.
-De asemenea, este solubil în uleiuri volatile și fixe.
-Este ușor solubil în eter de petrol.
-Solubilitatea sa în hexan este de 0,9 g / L, în metanol 71,5 g / L și în toluen 10,6 g / L.
Densitate
1,316 g / mL la 82,4 º F și 1,2659 g / mL la 15 ºC.
Densitatea vaporilor
4.21 (relativ la aer luat ca referință = 1)
Presiunea de vapori
1 mmHg la 205ºF și 7,0 x 10-4 mmHg la 25 ° C.
Stabilitate
O soluție cu o concentrație de 0,1% în apă este stabilă timp de cel puțin 8 săptămâni.
Descompunere
Se descompune la încălzire, emanând fum acru și iritant.
Viscozitate
1,26 cPoise la 130 ºC.
Căldura de ardere
3227 KJ / mol.
Căldura de vaporizare
534 KJ / mol la 249 ºC.
pH
Aproximativ 4 în apă.
Tensiune de suprafata
31 N / m la 130 ºC.
pKa
4.19 la 25 ° C.
Indicele de refracție
1,504 - 1,5397 (ηD) la 20 ° C.
Reacții
-În contact cu baze (NaOH, KOH etc.) formează săruri de benzoat. De exemplu, dacă reacționează cu NaOH, formează benzoat de sodiu, C6H5COONa.
-Reacționează cu alcooli pentru a forma esteri. De exemplu, reacția sa cu alcool etilic dă naștere esterului etilic. Unii esteri ai acidului benzoic servesc drept plastifianți.
-Reacționează cu pentaclorură de fosfor, PCl5, pentru a forma clorură de benzoil, o halogenură acidă. Clorura de benzoil poate reacționa cu amoniu (NH3) sau o amină cum ar fi metilamina (CH3NHDouă) pentru a forma benzamidă.
-Reacția acidului benzoic cu acidul sulfuric produce sulfonarea inelului aromatic. Grupul funcțional -SO3H înlocuiește un atom de hidrogen în poziția meta a inelului.
-Poate reacționa cu acidul azotic, cu utilizarea acidului sulfuric ca catalizator, formând acid meta-nitrobenzoic.
-În prezența unui catalizator, cum ar fi clorura ferică, FeCl3, acidul benzoic reacționează cu halogeni; de exemplu, reacționează cu clorul pentru a forma acidul metaclorobenzoic.
Producție
Unele metode de producție pentru acest compus sunt enumerate mai jos:
-Majoritatea acidului benzoic este produs industrial prin oxidarea toluenului cu oxigen din aer. Procesul este catalizat de naftenat de cobalt, la o temperatură de 140-160 ºC și la o presiune de 0,2 - 0,3 MPa.
-Pe de altă parte, toluenul poate fi clorurat pentru a produce benzotriclorură, care ulterior este hidrolizată în acid benzoic..
-Hidroliza benzonitrilului și benzamidei, într-un mediu acid sau alcalin, poate da naștere acidului benzoic și a bazelor sale conjugate..
-Alcoolul benzilic într-o oxidare mediată de permanganat de potasiu, într-un mediu apos, produce acid benzoic. Reacția are loc prin încălzire sau distilare prin reflux. Odată ce procesul este terminat, amestecul este filtrat pentru a elimina dioxidul de mangan, în timp ce supernatantul este răcit pentru a obține acid benzoic..
-Compusul benzotriclorid reacționează cu hidroxid de calciu, folosind fier sau săruri de fier ca catalizatori, formând inițial benzoat de calciu, Ca (C6H5GÂNGURI)Două. Apoi, această sare prin reacție cu acidul clorhidric este transformată în acid benzoic.
Aplicații
Industrial
-Se utilizează la producerea fenolului prin decarboxilarea oxidativă a acidului benzoic la temperaturi de 300-400 ° C. Cu ce scop? Deoarece fenolul poate fi utilizat în sinteza Nylonului.
-Din acesta se formează benzoatul de glicol, un precursor chimic al esterului dietilenglicolului și al esterului trietilenglicolului, substanțe utilizate ca plastifianți. Poate că cea mai importantă aplicație pentru plastifianți este formulările adezive. Unii esteri cu lanț lung sunt folosiți pentru a înmuia materialele plastice precum PVC.
-Este utilizat ca activator de polimerizare a cauciucului. În plus, este un intermediar în fabricarea rășinilor alchidice, precum și aditivi pentru aplicații în recuperarea țițeiului..
-În plus, este utilizat în producția de rășini, coloranți, fibre, pesticide și ca agent modificator pentru rășina poliamidică pentru producția de poliester. Se folosește pentru a menține aroma tutunului.
-Este un precursor al clorurii de benzoil, care este un material de pornire pentru sinteza compușilor, cum ar fi benzoatul de benzii, utilizat la fabricarea aromelor artificiale și a insectifugilor..
Medicinal
-Este o componentă a unguentului Whitfield care este utilizată pentru tratarea afecțiunilor fungice ale pielii, cum ar fi pecingine și piciorul de atlet. Unguentul Whitfield este alcătuit din 6% acid benzoic și 3% acid salicilic..
-Este un ingredient din tinctura de benzoină care a fost folosit ca antiseptic local și decongestionant inhalant. Acidul benzoic a fost folosit ca expectorant, analgezic și antiseptic până la începutul secolului al XX-lea.
-Acidul benzoic a fost utilizat în terapia experimentală a pacienților cu boli reziduale de acumulare de azot.
Conservarea alimentelor
Acidul benzoic și sărurile sale sunt utilizate în conservarea alimentelor. Compusul este capabil să inhibe creșterea mucegaiului, drojdiei și bacteriilor, printr-un mecanism dependent de pH..
Aceștia acționează asupra acestor organisme atunci când pH-ul lor intracelular scade la un pH mai mic de 5, inhibând aproape total fermentația anaerobă a glucozei pentru producerea acidului benzoic. Această acțiune antimicrobiană necesită un pH între 2,5 și 4 pentru o acțiune mai eficientă..
-Folosit pentru conservarea alimentelor precum sucurile de fructe, băuturile carbogazoase, băuturile răcoritoare cu acid fosforic, murăturile și alte alimente acidificate.
Dezavantaj
Poate reacționa cu acidul ascorbic (vitamina C) prezent în unele băuturi, producând benzen, un compus cancerigen. Din acest motiv, căutăm alți compuși cu capacitatea de a conserva alimentele care nu au probleme cu acidul benzoic..
Alții
-Se folosește în ambalaje active, fiind prezent în filmele ionomerice. Acid benzoic este eliberat din ele, capabil să inhibe creșterea speciilor din genurile Penicillium și Aspergillus în mediul microbian..
-Este folosit ca agent conservant pentru aroma sucului de fructe și a parfumului. De asemenea, este utilizat cu această aplicație în tutun.
-Acidul benzoic este folosit ca erbicid selectiv pentru combaterea buruienilor cu frunze late și a ierburilor din soia, castraveți, pepeni, arahide și ornamentale lemnoase..
Toxicitate
-În contact cu pielea și ochii poate provoca roșeață. Inhalarea poate provoca iritații ale tractului respirator și tuse. Ingerarea unor cantități mari de acid benzoic poate provoca tulburări gastro-intestinale, care pot duce la afectarea ficatului și a rinichilor.
-Acidul benzoic și benzoații pot elibera histamină care poate provoca reacții alergice și iritarea ochilor, a pielii și a membranelor mucoase..
-Nu are efect cumulativ, mutagen sau cancerigen, deoarece se absoarbe rapid în intestin, fiind eliminat în urină fără a se acumula în organism..
-Doza maximă permisă conform OMS este de 5 mg / kg de greutate corporală / zi, aproximativ 300 mg / zi. Doza de toxicitate acută la om: 500 mg / kg.
Referințe
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (10a ediție.). Wiley plus.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Carte chimică. (2017). Acid benzoic. Recuperat de pe: chemicalbook.com
- PubChem. (2018). Acid benzoic. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Acid benzoic. Recuperat de pe: en.wikipedia.org
- Dadachanji, Dinshaw. (18 mai 2018). Proprietățile chimice ale acidului benzoic. Știința. Recuperat de pe: sciencing.com
- Ministerul Muncii și Afacerilor Sociale Spania. (s.f.). Acid benzoic [PDF]. Carduri internaționale de siguranță chimică. Recuperat de pe: insht.es



Nimeni nu a comentat acest articol încă.