
Structura acidului carbonic (H2CO3), proprietăți, sinteză, utilizări
acid carbonic Este un compus anorganic, deși există cei care dezbat că este de fapt organic, a cărui formulă chimică este HDouăCO3. Prin urmare, este un acid diprotic, capabil să doneze doi ioni H+ la mediul apos pentru a genera doi cationi moleculari H3SAU+. Din acesta iau naștere binecunoscuții ioni bicarbonat (HCO3-) și carbonat (CO3Două-).
Acest acid particular, simplu, dar implicat în același timp în sistemele în care numeroase specii participă la un echilibru lichid-vapori, este format din două molecule anorganice fundamentale: apă și dioxid de carbon. Prezența CODouă nedizolvat se observă ori de câte ori există o clocotire în apă, care se ridică spre suprafață.

Acest fenomen este văzut foarte regulat în băuturile carbogazoase și în apa carbogazoasă..
În cazul apei carbogazoase sau carbogazoase (imaginea de mai sus), o astfel de cantitate de CO a fost dizolvatăDouă că presiunea sa de vapori este mai mult decât dublă față de presiunea atmosferică. Atunci când este neacoperit, diferența de presiune în interiorul sticlei și în exterior scade solubilitatea CODouă, deci apar bulele care ajung să scape din lichid.
Într-o măsură mai mică, același lucru se întâmplă în orice corp de apă proaspătă sau salină: atunci când sunt încălzite, vor elibera conținutul lor de CO dizolvat.Două.
Cu toate acestea, CODouă Nu numai că este dizolvat, dar suferă transformări în molecula sa care îl fac HDouăCO3; un acid care are o durată de viață prea mică, dar suficient pentru a marca o schimbare măsurabilă a pH-ului mediului său de solvent apos și, de asemenea, pentru a genera un sistem tampon unic de carbonat.
Indice articol
- 1 Structură
- 1.1 Molecula
- 1.2 Interacțiuni moleculare
- 1.3 Acid carbonic pur
- 2 Proprietăți
- 3 Sinteza
- 3.1 Dizolvarea
- 3.2 Echilibrul lichid-vapori
- 3.3 Solid pur
- 4 utilizări
- 5 Riscuri
- 6 Referințe
Structura
Moleculă
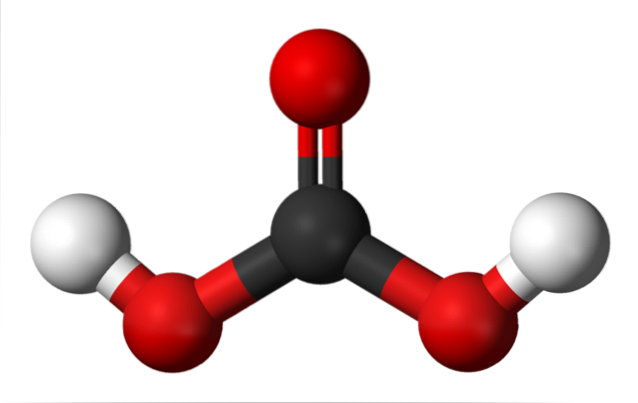
Deasupra avem molecula H.DouăCO3, reprezentată cu sfere și bare. Sferele roșii corespund atomilor de oxigen, negru atomului de carbon, iar albul atomilor de hidrogen.
Rețineți că pornind de la imagine puteți scrie o altă formulă validă pentru acest acid: CO (OH)Două, unde CO devine gruparea carbonil, C = O, legată de două grupări hidroxil, OH. Deoarece există două grupări OH, capabile să-și doneze atomii de hidrogen, acum se înțelege de unde provin ionii H+ eliberat la mijloc.
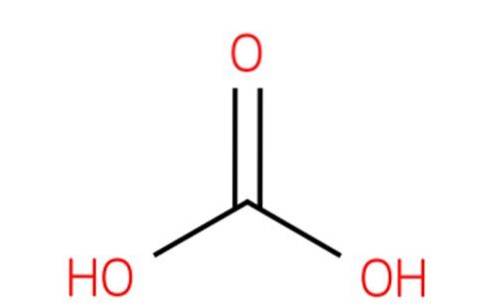
De asemenea, rețineți că formula CO (OH)Două poate fi scris ca OHCOOH; adică de tip RCOOH, unde R este în acest caz o grupare OH.
Din acest motiv, pe lângă faptul că molecula este alcătuită din atomi de oxigen, hidrogen și carbon, prea obișnuiți în chimia organică, acidul carbonic este considerat de unii ca fiind un compus organic. Cu toate acestea, în secțiunea privind sinteza sa, se va explica de ce alții consideră că este de natură anorganică și neorganică..
Interacțiuni moleculare
Din molecula H.DouăCO3 Se poate comenta că geometria sa este un plan trigonal, cu carbonul situat în centrul triunghiului. În două dintre vârfurile sale are grupări OH, care sunt donatori de legături de hidrogen; iar în celălalt rămas, un atom de oxigen din grupa C = O, acceptor al legăturilor de hidrogen.
Astfel, HDouăCO3 are o puternică tendință de a interacționa cu solvenți protici sau oxigenați (și azotați).
Și întâmplător, apa îndeplinește aceste două caracteristici, iar astfel este afinitatea lui HDouăCO3 pentru ea asta aproape imediat îi dă un H+ și începe să se stabilească un echilibru de hidroliză care implică specia HCO3- si H3SAU+.
De aceea simpla prezență a apei descompune acidul carbonic și face ca izolarea acestuia ca un compus pur să fie prea complicată..
Acid carbonic pur
Revenind la molecula H.DouăCO3, nu numai că este plat, capabil de legare cu hidrogen, dar poate prezenta și izomerism cis-trans; Aceasta este, în imagine avem izomerul cis, cu cei doi H îndreptați în aceeași direcție, în timp ce în izomerul trans ar indica în direcții opuse.
Izomerul cis este cel mai stabil dintre cele două și de aceea este singurul reprezentat de obicei.
Un solid pur de HDouăCO3 Se compune dintr-o structură cristalină compusă din straturi sau foi de molecule care interacționează cu legături laterale de hidrogen. Acest lucru este de așteptat, cu molecula HDouăCO3 plat și triunghiular. Când sunt sublimate, dimerii ciclici (HDouăCO3)Două, care sunt unite prin două legături de hidrogen C = O - OH.
Simetria cristalelor H.DouăCO3 nu a putut defini pentru moment. S-a considerat că cristalizează ca doi polimorfi: α-HDouăCO3 și β- HDouăCO3. Cu toate acestea, α-HDouăCO3, sintetizat pornind de la un amestec de CH3COOH-CODouă, s-a arătat că este de fapt CH3OCOOH: un ester monometilic al acidului carbonic.
Proprietăți
S-a menționat că HDouăCO3 este un acid diprotic, deci poate dona doi ioni H+ către un mediu care le acceptă. Când acest mediu este apă, ecuațiile disocierii sau hidrolizei sale sunt:
HDouăCO3(ac) + HDouăO (l) <=> HCO3-(ac) + H3SAU+(ac) (Ka1 = 2,5 × 10−4)
HCO3-(ac) + HDouăO (l) <=> CO3Două-(ac) + H3SAU+(ac) (KaDouă = 4,69 × 10−11)
HCO3- este anionul bicarbonat sau hidrogen carbonat și CO3Două- anionul carbonat. De asemenea, sunt indicate constantele lor de echilibru, Ka1 și KaDouă. Fiind KaDouă de cinci milioane de ori mai mic decât Ka1, formarea și concentrația de CO3Două- sunt de dispreț.
Astfel, chiar dacă este un acid diprotic, al doilea H+ abia îl poate elibera apreciabil. Cu toate acestea, prezența CODouă dizolvat în cantități mari este suficient să acidulați mediul; în acest caz, apa, scăzând valorile pH-ului (sub 7).
A vorbi despre acid carbonic înseamnă a se referi practic la o soluție apoasă în care predomină speciile HCO3- si H3SAU+; nu poate fi izolat prin metode convenționale, deoarece cea mai mică încercare ar schimba echilibrul solubilității CODouă la formarea de bule care ar scăpa din apă.
Sinteză
Dizolvare
Acidul carbonic este unul dintre cei mai ușor compuși de sintetizat. Cum? Cea mai simplă metodă este să balonăm, cu ajutorul unui paie sau paie, aerul pe care îl expirăm într-un volum de apă. Pentru că în esență expirăm CODouă, Acest lucru va apărea în apă, dizolvând o mică parte din ea.
Când facem acest lucru, apare următoarea reacție:
CODouă(g) + HDouăO (l) <=> HDouăCO3(ac)
Dar, la rândul său, trebuie luată în considerare solubilitatea CO.Două in apa:
CODouă(g) <=> CODouă(ac)
Atât CODouă ca HDouăO sunt molecule anorganice, deci HDouăCO3 este anorganic din acest punct de vedere.
Echilibrul lichid-vapori
Ca rezultat, avem un sistem în echilibru care este foarte dependent de presiunile parțiale ale CODouă, precum și temperatura lichidului.
De exemplu, dacă presiunea CODouă crește (în cazul în care suflăm aerul cu mai multă forță prin paie), se va forma mai mult HDouăCO3 iar pH-ul va deveni mai acid; întrucât primul echilibru se deplasează spre dreapta.
Pe de altă parte, dacă încălzim soluția de HDouăCO3, va scădea solubilitatea CODouă în apă, deoarece este un gaz, iar echilibrul se va deplasa apoi la stânga (va fi mai puțin HDouăCO3). Va fi similar dacă încercăm să aplicăm un vid: CODouă va scăpa la fel ca și moleculele de apă, ceea ce ar schimba din nou echilibrul spre stânga.
Solid pur
Cele de mai sus ne permit să ajungem la o concluzie: dintr-o soluție de HDouăCO3 nu există nicio modalitate de a sintetiza acest acid ca un solid pur printr-o metodă convențională. Cu toate acestea, s-a făcut, încă din anii 90 ai secolului trecut, începând de la amestecuri solide de CODouă si HDouăSAU.
La acest amestec solid CODouă-HDouăSau la 50% este bombardat cu protoni (un tip de radiație cosmică), astfel încât niciuna dintre cele două componente nu va scăpa și se produce formarea de HDouăCO3. Un amestec de CH a fost, de asemenea, utilizat în acest scop.3OH-CODouă (amintiți-vă α-HDouăCO3).
O altă metodă este de a face același lucru, dar folosind direct gheață uscată, nimic mai mult..
Dintre cele trei metode, oamenii de știință ai NASA au reușit să ajungă la o concluzie: acidul carbonic pur, solid sau gazos, poate exista în sateliții de gheață din Jupiter, în ghețarii marțieni și în comete, unde astfel de amestecuri solide sunt iradiate constant de raze cosmice..
Aplicații
Acidul carbonic în sine este un compus inutil. Cu toate acestea, din soluțiile sale pot fi preparate tampoane bazate pe perechile HCO.3-/ CO3Două- sau HDouăCO3/ HCO3-.
Datorită acestor soluții și acțiunii enzimei anhidrază carbonică, prezentă în celulele roșii din sânge, CODouă produs în respirație poate fi transportat în sânge la plămâni, unde este eliberat în cele din urmă pentru a fi expirat în afara corpului nostru.
Clocotitul de CODouă este folosit pentru a da băuturilor răcoritoare senzația plăcută și caracteristică pe care o lasă în gât atunci când le consumă.
La fel, prezența lui HDouăCO3 Are importanță geologică în formarea stalactitelor de calcar, deoarece le dizolvă încet până când își originează finisajele ascuțite.
Și, pe de altă parte, soluțiile sale pot fi utilizate pentru a prepara niște bicarbonați metalici; deși pentru aceasta este mai profitabil și mai ușor să folosiți direct o sare de bicarbonat (NaHCO3, de exemplu).
Riscuri
Acidul carbonic are o durată de viață atât de redusă în condiții normale (estimează în jur de 300 nanosecunde) încât este practic inofensiv pentru mediu și ființe vii. Cu toate acestea, așa cum am spus mai devreme, acest lucru nu implică faptul că nu poate genera o schimbare îngrijorătoare a pH-ului apei oceanelor, afectând fauna marină..
Pe de altă parte, „riscul” real se găsește în aportul de apă carbogazoasă, deoarece cantitatea de CODouă dizolvat în ele este mult mai mare decât în apa normală. Cu toate acestea, și din nou, nu există studii care să arate că consumul de apă carbogazoasă reprezintă un risc care pune viața în pericol; dacă chiar îl recomandă să postească și să combată indigestia.
Singurul efect negativ observat la cei care beau această apă este senzația de plenitudine, deoarece stomacul lor se umple de gaze. În afară de aceasta (ca să nu mai vorbim de băuturile răcoritoare, deoarece acestea sunt alcătuite din mult mai mult decât doar acid carbonic), se poate spune că acest compus nu este deloc toxic.
Referințe
- Day, R. și Underwood, A. (1989). Chimie analitică cantitativă (ediția a cincea). PEARSON Prentice Hall.
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Acid carbonic. Recuperat de pe: en.wikipedia.org
- Danielle Reid. (2019). Acid carbonic: video despre formare, structură și ecuație chimică. Studiu. Recuperat de la: study.com
- Götz Bucher și Wolfram Sander. (2014). Clarificarea structurii acidului carbonic. Vol. 346, Ediția 6209, pp. 544-545. DOI: 10.1126 / science.1260117
- Lynn Yarris. (22 octombrie 2014). Noi perspective asupra acidului carbonic în apă. Berkeley Lab. Recuperat de la: newscenter.lbl.gov
- Claudia Hammond. (2015, 14 septembrie). Este cu adevărat rău apa spumantă pentru tine? Recuperat de pe: bbc.com
- Jurgen Bernard. (2014). Acid carbonic solid și gazos. Institutul de chimie fizică. Universitatea din Innsbruck.



Nimeni nu a comentat acest articol încă.