
Structura acidului citric, proprietăți, producție și utilizări
acid citric este un compus organic format dintr-un acid slab a cărui formulă chimică este C6H8SAU7. După cum indică și numele, una dintre principalele sale surse naturale sunt citricele și derivă și din cuvântul latin „citrus”, care înseamnă amar..
Nu numai că este un acid slab, dar este și poliprotic; adică poate elibera mai mult de un ion hidrogen, H+. Este tocmai un acid tricarboxilic, deci are trei grupări -COOH care donează ioni H+. Fiecare dintre ei are propria tendință de a se elibera în mediul lor..

Prin urmare, formula sa structurală este mai bine definită ca C3H5O (COOH)3. Acesta este motivul chimic al contribuției sale la aroma caracteristică, de exemplu, a segmentelor portocalii. Deși provine din fructe, cristalele sale nu au fost izolate până în 1784 dintr-un suc de lămâie din Anglia.
Acesta reprezintă aproximativ 8% în masă din unele citrice, cum ar fi lămâile și grepfruturile. Poate fi găsit și în ardei, roșii, anghinare și alte alimente..
Indice articol
- 1 Unde se găsește acidul citric?
- 2 Structura acidului citric
- 2.1 Interacțiuni intermoleculare
- 3 Proprietăți fizice și chimice
- 3.1 Greutate moleculară
- 3.2 Aspect fizic
- 3.3 Aromă
- 3.4 Punctul de topire
- 3.5 Punctul de fierbere
- 3.6 Densitate
- 3.7 Solubilitate
- 3,8 pKa
- 3.9 Descompunerea
- 3.10 Derivate
- 4 Producție
- 4.1 Sinteza chimică sau sintetică
- 4.2 Natural
- 4.3 Prin fermentare
- 5 utilizări
- 5.1 În industria alimentară
- 5.2 În industria farmaceutică
- 5.3 În industria cosmetică și, în general
- 6 Toxicitate
- 7 Referințe
Unde se găsește acidul citric?
Se găsește în proporții scăzute la toate plantele și animalele și este un metabolit al ființelor vii. Este un compus intermediar al metabolismului aerob prezent în ciclul acidului tricarboxilic sau ciclul acidului citric. În biologie sau biochimie, acest ciclu este cunoscut și sub numele de ciclul Krebs, o cale de metabolizare a amfibolului.
Pe lângă faptul că se găsește în mod natural în plante și animale, acest acid se obține sintetic pe scară largă prin fermentare..
Este utilizat pe scară largă în industria alimentară, în produse farmaceutice și chimice și se comportă ca un conservant natural. Acesta și derivații săi sunt fabricați masiv la nivel industrial pentru a aromă alimentele solide și lichide.
Găsește utilizarea ca aditiv în varietățile de produse de înfrumusețare a pielii; este, de asemenea, utilizat ca agent chelator, acidifiant și antioxidant. Cu toate acestea, utilizarea sa în concentrații mari sau pure nu este recomandată; deoarece poate provoca iritații, alergii și chiar cancer.
Structura acidului citric
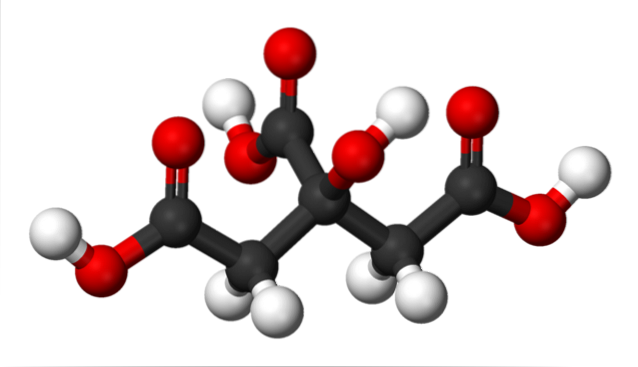
În imaginea superioară, structura acidului citric este reprezentată cu un model de sfere și bare. Dacă te uiți atent, poți găsi scheletul a doar trei atomi de carbon: propanul.
Atomul de carbon din centru este legat de o grupare -OH, care în prezența grupărilor carboxil, -COOH, adoptă terminologia „hidroxi”. Cele trei grupuri -COOH sunt ușor de recunoscut la capetele din stânga și din dreapta și în partea de sus a structurii; De aici sunt eliberate H+.
Pe de altă parte, grupul -OH este, de asemenea, capabil să piardă un proton acid, deci în total nu ar exista trei H+, dar patru. Cu toate acestea, acesta din urmă necesită o bază considerabil puternică și, în consecință, contribuția sa la aciditatea caracteristică a acidului citric este mult mai mică în comparație cu cea a grupelor -COOH..
Din toate cele de mai sus rezultă că acidul citric poate fi numit și: 2-hidroxi-1,2,3-tricarboxilic propan.
Există un grup -OH în C-2, care este adiacent grupului -COOH (uitați-vă la centrul superior al structurii). Din această cauză, acidul citric se încadrează și în clasificarea alfa-hidroxi acizilor; unde alfa înseamnă „adiacent”, adică există un singur atom de carbon care separă -COOH și -OH.
Interacțiuni intermoleculare
După cum se poate observa, structura acidului citric are o capacitate mare de a dona și accepta legături de hidrogen. Acest lucru îl face foarte legat de apă și, de asemenea, motivul pentru care formează foarte ușor un cristal monohidrat, romboedru..
Aceste legături de hidrogen sunt, de asemenea, responsabile pentru ridicarea cristalelor monoclinice incolore de acid citric. Cristalele anhidre (fără apă) pot fi obținute după formarea în apă fierbinte, urmată de evaporare completă..
Proprietati fizice si chimice
Greutate moleculară
210,14 g / mol.
Aspectul fizic
Cristale acide incolore și inodor.
Gust
Acru și amar.
Punct de topire
153 ° C.
Punct de fierbere
175 ° C.
Densitate
1,66 g / ml.
Solubilitate
Este un compus foarte solubil în apă. Este, de asemenea, foarte solubil în alți solvenți polari, cum ar fi etanol și acetat de etil. În solvenții apolari și aromatici precum benzen, toluen, cloroform și xilen, este insolubil.
pKa
-3.1
-4.7
-6.4
Acestea sunt valorile pKa pentru fiecare dintre cele trei grupuri -COOH. Rețineți că al treilea pKa (6,4) este abia ușor acid, deci disociază puțin.
Descompunere
La temperaturi extreme sau peste 175 ° C se descompune eliberând CODouă si apa. Prin urmare, lichidul nu atinge o fierbere semnificativă, deoarece se descompune mai întâi..
Derivate
Pe măsură ce pierzi H+, alți cationi își iau locul, dar într-un mod ionic; adică taxele negative ale grupurilor -COO- atrage alte specii de sarcini pozitive, cum ar fi Na+. Cu cât acidul citric este mai deprotonat, cu atât vor avea mai mulți cationi derivații săi numiți citrați.
Un exemplu este citratul de sodiu, care are un efect de chelare foarte util ca coagulant. Prin urmare, acești citrați pot forma complexe cu metale în soluție..
Pe de altă parte, H+ din grupele -COOH pot fi chiar înlocuite cu alte specii legate covalent, cum ar fi lanțurile laterale R, dând naștere la esteri de citrat: C3H5SAU (COOR)3.
Diversitatea este foarte mare, deoarece nu tot H trebuie neapărat înlocuit cu R, ci și cu cationi.
Producție
Acidul citric poate fi produs natural și comercial obținut prin fermentarea carbohidraților. Producția sa a fost, de asemenea, realizată sintetic prin procese chimice care nu sunt păstrate foarte actuale în prezent..
Pentru producerea sa au fost utilizate mai multe procese biotehnologice, deoarece acest compus este la mare căutare la nivel mondial.
Sinteza chimică sau sintetică
-Unul dintre aceste procese de sinteză chimică se efectuează în condiții de presiune ridicată din sărurile de calciu ale izocitratului. Sucul extras din citrice este tratat cu hidroxid de calciu și se obține citrat de calciu..
Această sare este apoi extrasă și reacționată cu o soluție diluată de acid sulfuric, a cărei funcție este de a protona citratul la forma acidă originală..
-Acidul citric a fost, de asemenea, sintetizat din glicerină prin înlocuirea componentelor sale cu o grupare carboxil. După cum sa menționat, aceste procese nu sunt optime pentru producerea pe scară largă de acid citric..
natural
În organism, acidul citric apare în mod natural în metabolismul aerob: ciclul acidului tricarboxilic. Când acetil coenzima A (acetil-CoA) intră în ciclu, se leagă cu acid oxaloacetic, formând acid citric..
Și de unde vine acetil-CoA?
În reacțiile catabolismului acizilor grași, carbohidrații, printre alte substraturi, în prezența ODouă se produce acetil-CoA. Acesta se formează ca produs al beta-oxidării acizilor grași, al transformării piruvatului generat în glicoliză.
Acidul citric format în ciclul Krebs sau cel al acidului citric va fi oxidat în acid alfa-ketoglutaric. Acest proces reprezintă o cale de reducere a oxidării amfibolice, din care se generează echivalenți care vor produce apoi energie sau ATP..
Cu toate acestea, producția comercială de acid citric ca intermediar al metabolismului aerob nu a fost nici profitabilă, nici satisfăcătoare. Doar în condiții de dezechilibru organic poate fi crescută concentrația acestui metabolit, ceea ce nu este viabil pentru microorganisme.
Prin fermentare
Microorganismele, cum ar fi ciupercile și bacteriile, produc acid citric prin fermentarea zaharurilor.
Producția de acid citric din fermentația microbiană a dat rezultate mai bune decât obținerea acestuia prin sinteză chimică. Au fost dezvoltate linii de cercetare legate de această metodă de producție comercială în masă, care a oferit avantaje economice mari..
Tehnicile de cultivare la nivel industrial au variat în timp. Au fost utilizate culturi pentru fermentația de suprafață și submersibilă. Culturile scufundate sunt cele în care microorganismele produc fermentație din substraturi conținute în mediu lichid.
Procesele de producție a acidului citric prin fermentare scufundată, care are loc în condiții anaerobe, au fost optime..
Unelor ciuperci le place Aspergillus niger, Saccahromicopsis sp, și bacterii ca Bacillus licheniformis, au permis să obțină un randament ridicat cu acest tip de fermentație.
Ciupercilor le place Aspergillus niger sau candida sp, Acestea produc acid citric ca rezultat al fermentării melasei și amidonului. De asemenea, zahărul de trestie, porumb și sfeclă, printre altele, este utilizat ca substraturi de fermentație..
Aplicații
Acidul citric este utilizat pe scară largă în industria alimentară, la fabricarea produselor farmaceutice. Este, de asemenea, utilizat în nenumărate procese chimice și biotehnologice..
În industria alimentară
-Acidul citric este utilizat în principal în industria alimentară, deoarece le conferă un gust acid plăcut. Este foarte solubil în apă, deci este adăugat la băuturi, dulciuri, bomboane, jeleuri și fructe congelate. Se folosește și la prepararea vinurilor, berilor, printre alte băuturi..
-Pe lângă adăugarea unei arome acide, inactivează oligoelemente care oferă protecție acidului ascorbic sau vitaminei C. Acționează și ca emulgator în înghețată și brânzeturi. Contribuie la inactivarea enzimelor oxidative prin scăderea pH-ului alimentelor.
-Crește eficiența conservanților adăugați în alimente. Oferind un pH relativ scăzut, scade probabilitatea ca microorganismele să supraviețuiască în alimentele procesate, crescând astfel durata lor de valabilitate..
-În grăsimi și uleiuri, acidul citric este utilizat pentru a consolida efectul antioxidant sinergic (al tuturor componentelor grase) pe care acest tip de nutrienți îl poate avea..
În industria farmaceutică
-Acidul citric este, de asemenea, utilizat pe scară largă ca excipient în industria farmaceutică pentru a îmbunătăți gustul și dizolvarea medicamentelor..
-În combinație cu bicarbonat, acidul citric este adăugat la produsele sub formă de pulbere și tablete într-un mod care acționează ca un efervescent.
-Sărurile acidului citric permit utilizarea acestuia ca anticoagulant, deoarece are capacitatea de a chela calciu. Acidul citric este administrat în suplimente minerale, cum ar fi sărurile de citrat.
-Prin acidificarea mediului procesului de absorbție la nivel intestinal, acidul citric optimizează absorbția vitaminelor și a unor medicamente. Forma sa anhidră este administrată ca adjuvant altor medicamente în dizolvarea pietrelor.
-Este, de asemenea, utilizat ca acidifiant, astringent, ca agent care facilitează dizolvarea ingredientelor active ale diferitelor produse farmaceutice..
În industria cosmetică și în general
-Acidul citric este utilizat ca agent de chelare pentru ionii metalici din articole de toaletă și produse cosmetice..
-Se folosește pentru curățarea și lustruirea metalelor în general, îndepărtând oxidul care le acoperă.
-La concentrații mici, servește ca aditiv în produsele ecologice de curățare, care sunt benigne pentru mediu și natură..
-Are o mare varietate de utilizări: este utilizat în reactivi fotografici, textile, în bronzarea pielii.
-Se adaugă la cernelurile de imprimare.
Toxicitate
Rapoartele despre toxicitatea sa sunt asociate cu o concentrație ridicată de acid citric, timp de expunere, impurități, printre alți factori..
Soluțiile de acid citric diluate nu prezintă niciun risc sau pericol pentru sănătate. Cu toate acestea, acidul citric pur sau concentrat prezintă un pericol pentru siguranță și, prin urmare, nu trebuie consumat..
Pur sau concentrat, este coroziv și iritant la contactul cu pielea și membranele mucoase ale ochilor, nasului și gâtului. Poate provoca reacții alergice ale pielii și toxicitate acută în caz de înghițire..
Inhalarea prafului de acid citric pur poate afecta și mucoasa căilor respiratorii. Inhalarea poate provoca dificultăți de respirație, alergii, sensibilizarea mucoasei respiratorii și poate declanșa chiar astm..
Sunt raportate efecte toxice asupra funcției de reproducere. Acidul citric poate provoca defecte genetice, provocând mutații în celulele germinale.
Și, în cele din urmă, este considerat periculos sau toxic pentru habitatul acvatic și, în general, acidul citric concentrat este coroziv pentru metale..
Referințe
- BellChem (21 aprilie 2015). Utilizările acidului citric în industria alimentară. Recuperat de la: bellchem.com
- Vandenberghe, Luciana P. S, Soccol, Carlos R, Pandey, Ashok și Lebeault, Jean-Michel. (1999). Producția microbiană de acid citric. Arhivele braziliene de biologie și tehnologie, 42 (3), 263-276. dx.doi.org/10.1590/S1516-89131999000300001
- PubChem. (2018). Acid citric. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Acid citric. Recuperat de pe: en.wikipedia.org
- Whitten, K., Davis, R., Peck M. și Stanley, G. (2008). Chimie. (8ava. ed). CENGAGE Învățare: Mexic.
- Berovic, M. și Legisa, M. (2007). Producția de acid citric. Revizuirea anuală a biotehnologiei. Recuperat de pe: researchgate.net



Nimeni nu a comentat acest articol încă.