
Formule de acid hiposulfuros, caracteristici și utilizări
acid hiposulfuros sau acidul dithionous este necunoscut, instabil în formă pură, nu are existență independentă și nu a fost detectat în soluție apoasă.
Teoretic ar fi un acid relativ slab, comparabil cu acidul sulfuros, H2SO3. Se cunosc doar sărurile sale, ditioniții, care sunt agenți reductori stabili și puternici. Sarea de sodiu a acidului dithionic este ditionitul de sodiu.

- Formule
| acid dithionous | anion dithionit | ditionit de sodiu | |
| Formule | H2S2O4 | S2O42− | Na2S2O4 |
- CAS: 20196-46-7 acid hiposulfuros (sau dithionous)
- CAS: 14844-07-6 acid hiposulfuric (sau ioniu ionic)
- CAS: 7775-14-6 ditionit de sodiu (sare de sodiu a acidului dithionous)
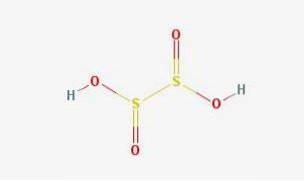
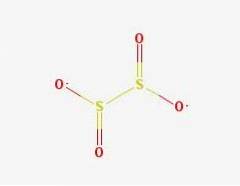
Structura 2D
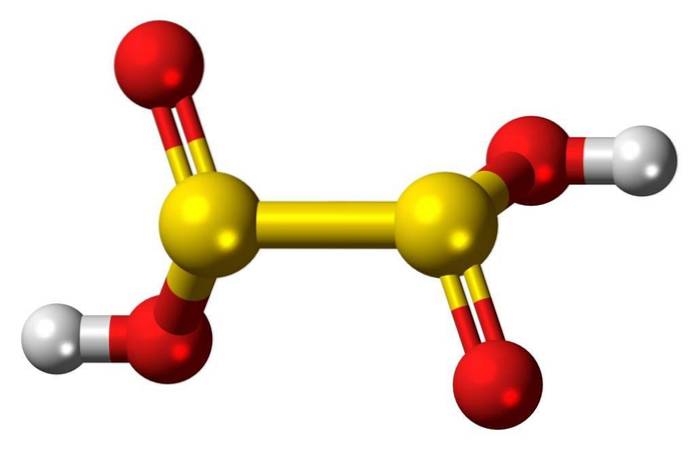
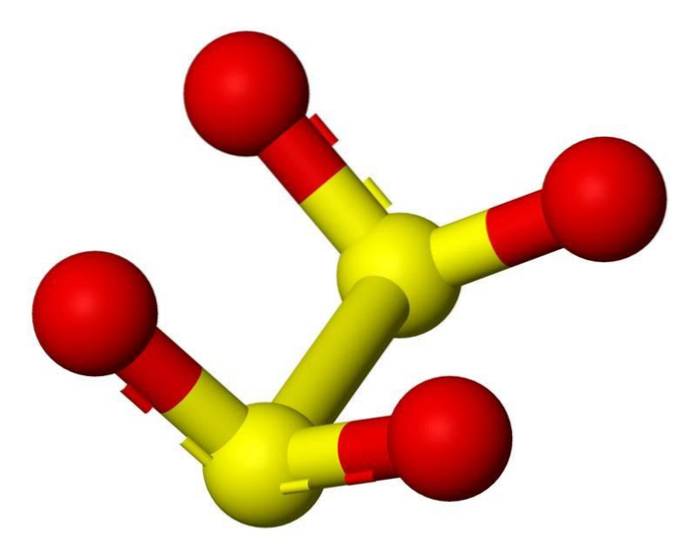
Structura 3D
Caracteristici
Proprietati fizice si chimice
| acid dithionous | anion dithionit | ditionit de sodiu | |
| Aspect: | . | . | Pulbere cristalină albă până la aproape albă |
| . | . | Fulgi ușori de lămâie | |
| Miros: | . | . | Miros slab de sulf |
| Greutate moleculară: | 130,122 g / mol | 128,116 g / mol | 174,096 g / mol |
| Punct de fierbere: | . | . | Se descompune |
| Punct de topire: | . | . | 52 ° C |
| Densitate: | . | . | 2,38 g / cm3 (anhidru) |
| Solubilitatea apei | . | . | 18,2 g / 100 ml (anhidru, 20 ° C) |
Acidul hiposulfuros este un oxo acid sulfuric cu formula chimică H2S2O4.
Oxoacizii de sulf sunt compuși chimici care conțin sulf, oxigen și hidrogen. Cu toate acestea, unele dintre ele sunt cunoscute doar din sărurile lor (cum ar fi acidul hiposulfuric, acidul dicionic, acidul disulfidic și acidul sulfuros).
Printre caracteristicile structurale ale oxoacizilor care au fost caracterizați avem:
- Sulf tetraedric atunci când este coordonat cu oxigenul
- Atomi de oxigen punte și terminale
- Grupuri peroxo terminale
- Terminalele S = S
- Șiruri de (-S-) n
Acidul sulfuric este cel mai cunoscut oxoacid de sulf și cel mai important din punct de vedere industrial.
Anionul ditionit ([S2O4] 2-) este un oxoanion (un ion cu formula generică AXOY z-) de sulf derivat formal din acidul ditionic.
Ionii de ditionită suferă atât hidroliză acidă, cât și alcalină în tiosulfat și bisulfit, respectiv sulfit și sulfură, respectiv:
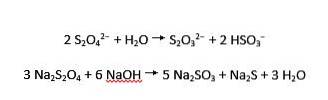
Sarea de sodiu a acidului dithionous este ditionitul de sodiu (cunoscut și sub numele de hidrosulfit de sodiu).
Ditionitul de sodiu este o pulbere cristalină albicioasă până la galben deschis, care are un miros similar cu dioxidul de sulf..
Se încălzește spontan la contactul cu aerul și umiditatea. Această căldură poate fi suficientă pentru a aprinde materialele combustibile din jur..
Sub expunere prelungită la foc sau căldură intensă, recipientele din acest material se pot rupe violent..
Este utilizat ca agent de reducere și ca agent de înălbire. Se folosește și pentru albirea pastei de hârtie și în vopsire. De asemenea, este utilizat pentru a reduce gruparea nitro la o grupare amino în reacțiile organice..
Deși stabil în majoritatea condițiilor, se descompune în apă fierbinte și soluții acide.
Poate fi obținut din bisulfit de sodiu prin următoarea reacție:
2 NaHSO3 + Zn → Na2S2O4 + Zn (OH) ²
Reacțiile aerului și apei
Ditionitul de sodiu este un solid combustibil care se descompune încet atunci când este în contact cu apa sau vaporii de apă, formând tiosulfați și bisulfiți..
Această reacție produce căldură, care poate accelera și mai mult reacția sau poate provoca arderea materialelor din jur. Dacă amestecul este limitat, reacția de descompunere poate duce la presurizarea recipientului, care se poate rupe cu forță. Stând în aer, se oxidează încet, generând gaze toxice cu dioxid de sulf.
Pericol de incendiu
Ditionitul de sodiu este un material inflamabil și combustibil. Se poate aprinde la contactul cu aerul umed sau umezeala. Poate arde rapid cu efect de flacără. Poate reacționa viguros sau exploziv în contact cu apa.
Se poate descompune exploziv atunci când este încălzit sau implicat în incendiu. Poate fi reaprins după stingerea incendiului. Scurgerea poate crea un pericol de incendiu sau explozie. Recipientele pot exploda la încălzire.
Pericol pentru sanatate
La contactul cu focul, Ditionitul de sodiu va produce gaze iritante, corozive și / sau toxice. Inhalarea produselor de descompunere poate provoca vătămări grave sau moartea. Contactul cu substanța poate provoca arsuri severe ale pielii și ochilor. Scurgerea de la controlul focului poate provoca poluare.
Aplicații
Ionul ditionit este utilizat, adesea împreună cu un agent de complexare (de exemplu, acidul citric), pentru a reduce oxidroxidul de fier (III) în compuși solubili din fier (II) și pentru a îndepărta fazele minerale care conțin fier amorf (III) în analiza solului (extracție selectivă) ).
Dithionita crește solubilitatea fierului. Datorită afinității puternice a ionului ditionit pentru cationii metalici bivalenți și trivalenți, este utilizat ca agent de chelare..
Descompunerea ditionitei produce specii reduse de sulf care pot fi foarte agresive pentru coroziunea oțelului și a oțelului inoxidabil..
Printre aplicațiile de ditionită de sodiu avem:
În industrie
Acest compus este o sare solubilă în apă și poate fi utilizat ca agent de reducere în soluții apoase. Se utilizează ca atare în unele procese industriale de vopsire, în principal în cele care implică coloranți de sulf și coloranți cuva, în care un colorant insolubil în apă poate fi redus la o sare de metal alcalin solubil în apă (de exemplu, colorantul indigo).
Proprietățile reducătoare ale ditionitei de sodiu elimină, de asemenea, excesul de colorant, oxidul rezidual și pigmenții nedoriti, îmbunătățind astfel calitatea generală a culorii..
Ditionitul de sodiu poate fi utilizat și pentru tratarea apei, purificarea gazelor, curățarea și extracția. Poate fi folosit și în procesele industriale ca agent de sulfonare sau ca sursă de ion de sodiu.
În plus față de industria textilă, acest compus este utilizat în industriile legate de piele, alimente, polimeri, fotografie și multe altele. De asemenea, utilizat ca agent de înălbire în reacțiile organice.
În științele biologice
Ditionitul de sodiu este adesea utilizat în experimentele de fiziologie ca mijloc de reducere a potențialului redox al soluțiilor..
În științele geologice
Ditionitul de sodiu este adesea utilizat în experimentele de chimie a solului pentru a determina cantitatea de fier care nu este încorporată în mineralele silicat primare..
Siguranță și riscuri
Declarații de pericol ale Sistemului global armonizat de clasificare și etichetare a substanțelor chimice (GHS)
Sistemul global de armonizare a clasificării și etichetării substanțelor chimice (GHS) este un sistem agreat la nivel internațional, creat de Națiunile Unite și conceput pentru a înlocui diferitele standarde de clasificare și etichetare utilizate în diferite țări prin utilizarea unor criterii consistente la nivel global..
Clasele de pericol (și capitolul corespunzător al GHS), standardele de clasificare și etichetare și recomandările pentru ditionitul de sodiu sunt următoarele (Agenția Europeană pentru Produse Chimice, 2017; Națiunile Unite, 2015; PubChem, 2017):



Referințe
- Benjah-bmm27, (2006). Un model cu bilă și stick al ionului ditionit [imagine] Recuperat de pe wikipedia.org.
- Drozdova, Y., Steudel, R., Hertwig, R. H., Koch, W. și Steiger, T. (1998). Structuri și energii ale diferiților izomeri ai acidului dithionous, H2S2O4 și ale anionului său HS2O4-1. Jurnalul de chimie fizică A, 102 (6), 990-996. Recuperat de pe: mycrandall.ca
- Agenția Europeană pentru Produse Chimice (ECHA). (2017). Rezumatul clasificării și etichetării. Clasificare armonizată - Anexa VI la Regulamentul (CE) nr. 1272/2008 (Regulamentul CLP). Ditionit de sodiu, hidrosulfit de sodiu. Adus pe 2 februarie 2017, de pe: echa.europa.eu
- Jynto (discuție), (2011). Dithionous-acid-3D-balls [imagine] Recuperat de la: https://en.wikipedia.org/wiki/Dithionous_acid#/media/File:Dithionous-acid-3D-balls.png
- LHcheM, (2012). Eșantion de ditionit de sodiu [imagine] Recuperat de pe: wikipedia.org.
- Mills, B. (2009). Sodiu-ditionit-xtal-1992-3D-bile [imagine] Recuperat de pe: wikipedia.org.
- Națiunile Unite (2015). Sistemul armonizat global de clasificare și etichetare a substanțelor chimice (GHS) a șasea ediție revizuită. New York, UE: Publicația Națiunilor Unite. Recuperat din: unece.orgl
- Centrul Național pentru Informații despre Biotehnologie. Baza de date compusă PubChem. (2017). Dithionite. Bethesda, MD, UE: Biblioteca Națională de Medicină. Recuperat de la: pubchem.ncbi.nlm.nih.gov.
- Centrul Național pentru Informații despre Biotehnologie. Baza de date PubChem Compound. (2017). Acid dithionous. Bethesda, MD, UE: Biblioteca Națională de Medicină. Recuperat de la: nih.gov.
- Centrul Național pentru Informații despre Biotehnologie. Baza de date compusă PubChem. (2017). Ditionita de sodiu. Bethesda, MD, UE: Biblioteca Națională de Medicină. Recuperat de la: nih.gov.
- Administrația Națională Oceanică și Atmosferică (NOAA). CAMEO Chemicals. (2017). Fișă tehnică chimică. Ditionita de sodiu. Silver Spring, MD. EU; Recuperat de la: cameochemicals.noaa.gov
- PubChem, (2016). Dithionite [imagine] Recuperat de la: nih.gov.
- PubChem, (2016). Dithionite [imagine] Recuperat de la: nih.gov.
- PubChem, (2016). Dithionous acid [imagine] Recuperat de la: nih.gov.
- Wikipedia. (2017). Dithionite. Adus pe 2 februarie 2017, de pe: wikipedia.org.
- Wikipedia. (2017). Acid_dithionous. Adus pe 2 februarie 2017, de pe: wikipedia.org.
- Wikipedia. (2017). Oxyanion. Adus pe 2 februarie 2017, de pe: wikipedia.org.
- Wikipedia. (2017). Ditionita de sodiu. Adus pe 2 februarie 2017, de pe: wikipedia.org.
- Wikipedia. (2017). Oxoacid de sulf. Adus pe 2 februarie 2017, de pe: wikipedia.org.

Nimeni nu a comentat acest articol încă.