
Structura acidului sulfuros, proprietăți, nomenclatură, utilizări
acid sulfuric este un oxacid care se formează prin dizolvarea dioxidului de sulf, SODouă, in apa. Este un acid anorganic slab și instabil, care nu a fost detectat în soluție, deoarece reacția de formare a acestuia este reversibilă, iar acidul se descompune rapid în reactivii care l-au produs (SODouă si HDouăSAU).
Molecula de acid sulfuric a fost detectată până acum doar în faza gazoasă. Bazele conjugate ale acestui acid sunt anioni comuni sub forme de sulfiți și bisulfiți..
SWDouă + HDouăSAU <=> HSO3- + H+
Acest lucru indică faptul că folosind spectrul Raman nu este posibil să se detecteze prezența acidului sulfuros într-o soluție de dioxid de sulf în apă..
Când este expus la atmosferă, se transformă rapid în acid sulfuric. Acidul sulfuros este redus la hidrogen sulfurat prin acțiunea acidului sulfuric diluat și a zincului.
Încercarea de a concentra o soluție de sistem de operareDouă prin evaporarea apei pentru a obține acid sulfuric fără apă, nu a produs rezultate, deoarece acidul se descompune rapid (inversând reacția de formare), deci acidul nu poate fi izolat.
Indice articol
- 1 Formare naturală
- 2 Structura
- 2.1 Molecula izolată
- 2.2 Molecula înconjurată de apă
- 2,3 SO2 ∙ nH2O
- 3 Proprietăți fizice și chimice
- 3.1 Formula moleculară
- 3.2 Greutate moleculară
- 3.3 Aspect fizic
- 3.4 Densitatea
- 3.5 Densitatea vaporilor
- 3.6 Corozivitate
- 3.7 Solubilitate în apă
- 3.8 Sensibilitate
- 3.9 Stabilitate
- 3.10 constantă de aciditate (Ka)
- 3,11 pKa
- 3.12 pH
- 3.13 Punct de aprindere
- 3.14 Descompunerea
- 4 Nomenclatură
- 5 Sinteza
- 6 utilizări
- 6.1 În pădure
- 6.2 Agent de dezinfectare și decolorare
- 6.3 Agent conservant
- 6.4 Alte utilizări
- 7 Referințe
Formarea naturală
Acidul sulfuros se formează în natură prin combinarea dioxidului de sulf, produs al activității marilor fabrici, cu apa atmosferică. Din acest motiv, este considerat ca un produs intermediar al ploilor acide, provocând mari daune agriculturii și mediului..
Forma sa acidă nu este utilizabilă în natură, dar este de obicei preparată în sărurile sale, sulfit și bisulfit de sodiu și potasiu..
Sulfitul este generat endogen în organism ca urmare a metabolismului aminoacizilor care conțin sulf. La fel, sulfitul este produs ca produs al fermentării alimentelor și băuturilor. Sulfitul este alergenic, neurotoxic și metabolic. Este metabolizat de enzima sulfit oxidază care o transformă în sulfat, un compus inofensiv.
Structura
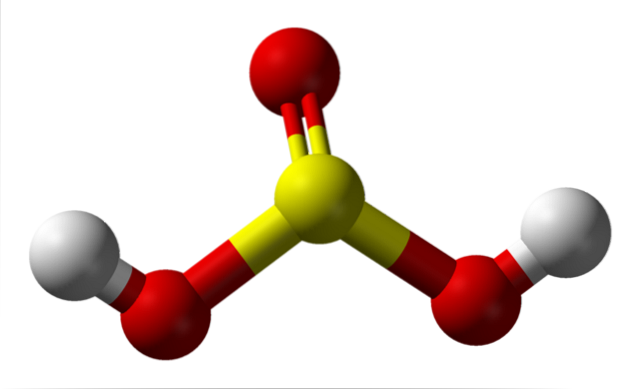
Moleculă izolată
În imagine puteți vedea structura unei molecule izolate de acid sulfuric în stare gazoasă. Sfera galbenă din centru corespunde atomului de sulf, cele roșii atomilor de oxigen, iar cele albe hidrogenilor. Geometria sa moleculară din jurul atomului S este o piramidă trigonală, cu atomii de O care trasează baza.
Apoi, în stare gazoasă, moleculele de HDouăSW3 poate fi considerat ca fiind mici piramide trigonale care plutesc în aer, presupunând că este suficient de stabilă pentru a rezista o vreme fără a reacționa.
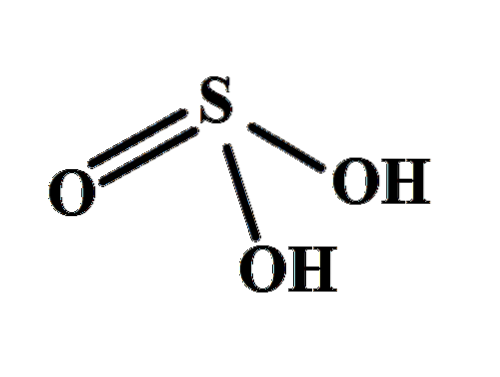
Structura clarifică de unde provin cei doi hidrogeni acizi: din grupările hidroxil legate de sulf, HO-SO-OH. Prin urmare, pentru acest compus, nu este corect să presupunem că unul dintre protonii acizi, H+, este eliberat din atomul de sulf, H-SODouă(OH).
Cele două grupări OH permit acidului sulfuros să interacționeze prin legături de hidrogen și, în plus, oxigenul legăturii S = O este un acceptor de hidrogen, care convertește HDouăSW3 atât un bun donator, cât și un acceptor al acestor poduri.
Conform celor de mai sus, HDouăSW3 ar trebui să fie capabil să se condenseze într-un lichid, la fel ca acidul sulfuric, HDouăSW4. Cu toate acestea, nu așa se întâmplă.
Molecula înconjurată de apă
Până în prezent, nu a fost posibil să se obțină acid sulfuric anhidru, adică HDouăSW3(l); în timp ce HDouăSW4(ac), pe de altă parte, după deshidratare, se transformă în forma sa anhidră, HDouăSW4(l), care este un lichid dens și vâscos.
Dacă se presupune că molecula de HDouăSW3 rămâne neschimbată, apoi se va putea dizolva în mare măsură în apă. Interacțiunile care ar guverna în soluțiile apoase menționate ar fi din nou legături de hidrogen; Cu toate acestea, interacțiunile electrostatice ar exista și ca urmare a echilibrului de hidroliză:
HDouăSW3(ac) + HDouăO (l) <=> HSO3-(ac) + H3SAU+(ac)
HSO3-(ac) + HDouăO (l) <=> SW3Două-(ac) + H3SAU+
Ionul sulfit, SO3Două- Ar fi aceeași moleculă ca mai sus, dar fără sferele albe; și ionul hidrogen sulfit (sau bisulfit), HSO3-, păstrează o sferă albă. Infinitățile de săruri pot apărea din ambii anioni, unii mai instabili decât alții.
În realitate, s-a confirmat că o porțiune extrem de mică a soluțiilor constă din HDouăSW3; adică molecula explicată nu este cea care interacționează direct cu moleculele de apă. Motivul pentru aceasta este că suferă descompunerea cauzând SODouă si HDouăSau, care este favorizat termodinamic.
SWDouă∙nHDouăSAU
Adevărata structură a acidului sulfuros constă dintr-o moleculă de dioxid de sulf înconjurată de o sferă de apă care este alcătuită din n molecule..
Astfel, SODouă, a cărei structură este unghiulară (tip boomerang), împreună cu sfera sa apoasă, este responsabilă pentru protonii acizi care caracterizează aciditatea:
SWDouă∙ nHDouăO (ac) + HDouăO (l) <=> H3SAU+(ac) + HSO3-(ac) + nHDouăO (l)
HSO3-(ac) + HDouăO (l) <=> SW3Două-(ac) + H3SAU+
În plus față de acest echilibru, există și un echilibru de solubilitate pentru SODouă, a cărei moleculă poate scăpa din apă în faza gazoasă:
SWDouă(g) <=> SWDouă(ac)
Proprietati fizice si chimice
Formulă moleculară
HDouăSW3
Greutate moleculară
82,073 g / mol.
Aspectul fizic
Este un lichid incolor, cu miros înțepător de sulf.
Densitate
1,03 g / ml.
Densitatea vaporilor
2.3 (în raport cu aerul luat ca 1)
Corozivitate
Este coroziv pentru metale și țesături.
Solubilitatea apei
Miscibil cu apă.
Sensibilitate
Este sensibil la aer.
Stabilitate
Stabil, dar incompatibil cu baze puternice.
Constanta de aciditate (Ka)
1,54 x 10-Două
pKa
1.81
pH
1,5 pe scara pH-ului.
punctul de aprindere
Nu este inflamabil.
Descompunere
Când este încălzit, acidul sulfuros se poate descompune, emițând fum toxic de oxid de sulf..
Nomenclatură
Sulful are următoarele valențe: ± 2, +4 și +6. Din formula HDouăSW3, se poate calcula valența sau numărul de oxidare al sulfului din compus. Pentru a face acest lucru, rezolvați doar o sumă algebrică:
2 (+1) + 1v + 3 (-2) = 0
Deoarece este un compus neutru, suma sarcinilor atomilor care îl constituie trebuie să fie 0. Rezolvând v pentru ecuația anterioară, avem:
v = (6-2) / 1
Astfel, v este egal cu +4. Adică, sulful participă cu a doua sa valență și, conform nomenclaturii tradiționale, sufixul -oso trebuie adăugat la nume. Din acest motiv la HDouăSW3 este cunoscut sub numele de acid sulfuricurs.
Un alt mod mai rapid de a determina această valență este comparând HDouăSW3 cu HDouăSW4. În HDouăSW4 sulful are o valență de +6, deci dacă se elimină un O, valența scade la +4; iar dacă se elimină alta, valența scade la +2 (ceea ce ar fi cazul acidului sughiţsulfurs, HDouăSWDouă).
Deși mai puțin cunoscut, la HDouăSW3 Poate fi numit și acid trioxosulfuric (IV), conform nomenclaturii stocului.
Sinteză
Tehnic se formează prin arderea sulfului pentru a forma dioxid de sulf. Acesta se dizolvă apoi în apă pentru a forma acid sulfuros. Cu toate acestea, reacția este reversibilă și acidul se descompune rapid în reactanți..
Aceasta este o explicație a motivului pentru care acidul sulfuric nu se găsește în soluția apoasă (așa cum sa menționat deja în secțiunea privind structura sa chimică).
Aplicații

În general, utilizările și aplicațiile acidului sulfuric, deoarece prezența acestuia nu poate fi detectată, se referă la utilizările și aplicațiile soluțiilor de dioxizi de sulf și bazele și sărurile acidului..
În pădure
În procesul de sulfit, pasta de lemn este produsă sub formă de fibre de celuloză aproape pure. Diferite săruri de acid sulfuric sunt folosite pentru a extrage lignina din așchii de lemn, folosind vase de înaltă presiune numite digistori..
Sărurile utilizate în procesul de obținere a pastei de lemn sunt sulfit (SO3Două-) sau bisulfit (HSO3-), în funcție de pH. Contraionul poate fi Na+, ACDouă+, K+ sau NH4+.
Agent de dezinfectare și decolorare
-Acidul sulfuros este utilizat ca dezinfectant. Este, de asemenea, utilizat ca agent de înălbire ușor, în special pentru materialele sensibile la clor. În plus, este folosit ca albire a dinților și aditiv alimentar.
-Este un ingredient din diverse produse cosmetice pentru îngrijirea pielii și a fost folosit ca element pesticid în eliminarea șobolanilor. Elimină petele cauzate de vin sau fructe pe diferite țesături.
-Servește ca antiseptic, fiind eficient în prevenirea infecțiilor pielii. În unele momente, a fost folosit în fumigații pentru dezinfectarea navelor, a bunurilor victimelor bolnave ale epidemiilor etc..
Agent conservant
Acidul sulfuros este folosit ca conservant pentru fructe și legume și pentru a preveni fermentarea băuturilor precum vinul și berea, fiind un element antioxidant, antibacterian și fungicid..
Alte utilizări
-Acidul sulfuros este utilizat în sinteza medicamentelor și a substanțelor chimice; în producția de vin și bere; rafinarea produselor petroliere; și este utilizat ca reactiv analitic.
-Bisulfitul reacționează cu nucleozidele pirimidinei și se adaugă la dubla legătură între poziția 5 și 6 a pirimidinei, modificând legătura. Transformarea bisulfitului este utilizată pentru a testa structurile secundare sau superioare ale polinucleotidelor.
Referințe
- Wikipedia. (2018). Acid sulfuric. Recuperat de pe: en.wikipedia.org
- Nomenclatura acizilor. [PDF]. Recuperat de la: 2.chemistry.gatech.edu
- Voegele F. Andreas & col. (2002). Despre stabilitatea acidului sulfuros (HDouăSW3) și dimerul său. Chem. Eur. J. 2002. 8, nr. 24.
- Shiver & Atkins. (2008). Chimie anorganică. (Ediția a patra., P. 393). Mc Graw Hill.
- Calvo Flores F. G. (s.f.). Formulare chimie anorganică. [PDF]. Recuperat de pe: ugr.es
- PubChem. (2018). Acid sulfuric. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Steven S. Zumdahl. (15 august 2008). Oxiacid. Encyclopædia Britannica. Recuperat de pe: britannica.com


Nimeni nu a comentat acest articol încă.