
Proprietăți, riscuri și utilizări ale clorurii de litiu (LiCl)
Clorură de litiu Este un compus chimic cu formula LiCl care poate fi obținut prin aprinderea litiului și a clorului, deși este dificil, deoarece reacția este violentă. În acest fel se produce forma anhidră (fără apă). Clorura de litiu poate fi extrasă și din alte cloruri de metale alcaline cu alcool amilic..
Până în anii 1990, piața metalelor și a litiului a fost dominată de producția SUA din zăcăminte de minerale. Cu toate acestea, la începutul secolului 21, cea mai mare parte a producției provenea din surse din afara SUA, Australia, Chile și Portugalia fiind cei mai importanți furnizori din lume..
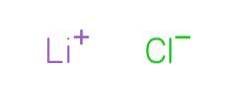
Ca o curiozitate, este demn de remarcat faptul că, deși Bolivia are jumătate din depozitele de litiu din lume, nu este un mare producător.
Cea mai importantă formă comercială este carbonatul de litiu, LiDouăCO3, produs din minerale sau saramură prin mai multe procese diferite.
Adăugarea acidului clorhidric (HCI) produce clorură de litiu. Cu această metodă, se produce compusul hidratat (apa legată de moleculă). Forma hidratată poate fi uscată până la forma anhidră prin încălzirea acesteia cu acid clorhidric gazos..
Proprietățile fizice și chimice ale clorurii de litiu
Clorura de litiu este un solid alb, fără aromă specială și gust sărat (Centrul Național pentru Informații despre Biotehnologie, 2005). Aspectul său este prezentat în figura 2.

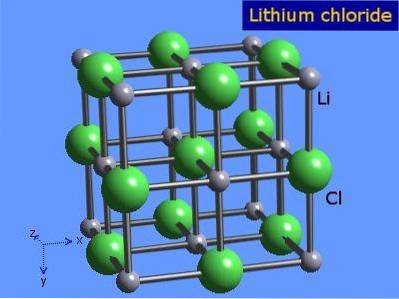
Clorura de litiu sunt cristale foarte higroscopice cu o geometrie octaedrică similară cu cea a clorurii de sodiu. Structura sa cristalină este prezentată în figura 3 (Winter, S.F.).
Greutatea sa moleculară este de 42,39 g / mol, densitatea sa este de 2,068 g / mL, iar punctele sale de topire și fierbere sunt de 605 ºC și respectiv 1360 ºC..
Compusul este foarte solubil în apă, alcool, eter, piridină și nitrobenzen (Royal Society of Chemistry, 2015).
Clorura de litiu are o putere de oxidare sau de reducere slabă. Cu toate acestea, pot apărea reacții redox. Soluțiile de clorură de litiu nu sunt în general nici puternic acide, nici puternic bazice..
Deoarece este extrem de higroscopic, clorura de litiu poate absorbi, de asemenea, până la patru echivalenți de amoniac pe mol. Soluțiile apoase de clorură de litiu pot coroda metalele (CLORURA DE LITIU, S.F.).
Reactivitate și pericole
Clorura de litiu este un compus stabil incompatibil cu agenți oxidanți puternici, acizi puternici, triclorură de brom, trifluorură de brom.
Nu este toxic dacă este înghițit, dar, datorită naturii sale corozive, poate fi iritant în contact cu pielea și ochii, poate irita și pasajele nazale (Institutul Național pentru Sănătate și Securitate în Muncă, 2015).
În caz de contact cu ochii, verificați dacă purtați lentile de contact și scoateți-le imediat..
Ochii trebuie spălați cu apă curentă timp de cel puțin 15 minute, ținând pleoapele deschise. Se poate folosi apa rece. Unguentul pentru ochi nu trebuie utilizat.
Dacă substanța chimică intră în contact cu îmbrăcămintea, îndepărtați-o cât mai repede posibil, protejându-vă propriile mâini și corp.
Așezați victima sub un duș de siguranță. Dacă substanța chimică se acumulează pe pielea expusă a victimei, cum ar fi mâinile, pielea contaminată este spălată ușor și cu grijă cu apă curentă și săpun non-abraziv..
Se poate folosi apa rece. Dacă iritația persistă, solicitați asistență medicală. Spălați hainele contaminate înainte de a le folosi din nou.
În caz de inhalare, victima trebuie lăsată să se odihnească într-o zonă bine ventilată. Dacă inhalarea este severă, victima trebuie evacuată într-o zonă sigură cât mai curând posibil..
Slăbiți îmbrăcămintea strânsă, cum ar fi gulerul, cămașa sau cravata cămășii. Dacă victimei îi este greu să respire, trebuie administrat oxigen.
Dacă victima nu respiră, se efectuează resuscitarea gură la gură. Ținând cont întotdeauna că poate fi periculos pentru persoana care acordă ajutor să ofere resuscitare gură la gură atunci când materialul inhalat este toxic, infecțios sau coroziv..
În toate cazurile, trebuie solicitată asistență medicală imediată (Fișa tehnică de securitate a clorurii de litiu, 2013).
Aplicații
Clorura de litiu este compusul utilizat pentru a produce litiu metalic prin electroliză. Litiul metalic este produs prin electroliza unui amestec topit de litiu și cloruri de potasiu.
Punctul de topire inferior al amestecului (400-420 ° C sau 750-790 ° F) în comparație cu cel al clorurii de litiu pur (610 ° C sau 1130 ° F) permite funcționarea la o temperatură mai mică a electrolizei.
Deoarece tensiunea la care are loc descompunerea clorurii de litiu este mai mică decât cea a clorurii de potasiu, litiul se depune la un nivel de puritate mai mare de 97% (Dye, 2017).
Clorura de litiu lichidă servește ca un desicant care poate reduce nivelul de umiditate din aerul înconjurător cu până la 15%.
Deshidratanții lichizi care combină clorura de litiu și clorura de calciu creează o substanță mai ieftină decât clorura de litiu, dar mai stabilă decât clorura de calciu..
Clorura de litiu răcește rapid aerul, deoarece substanța chimică conține o cantitate extraordinară de apă pentru greutatea sa ca solid. Substanța usucă, de asemenea, cantități mari de gaze industriale.
Clorura de litiu este un colorant roșu în afișajele pirotehnice, cum ar fi artificiile. Clorura de litiu sau orice sare pe bază de litiu solubilă în apă, arde roșu la pornire.
Efectele pirotehnice speciale pot fi aprinse prin amestecarea sărurilor ionice cu lichide inflamabile, cum ar fi alcoolul metilic..
În anii 1940, clorura de litiu a servit ca înlocuitor al sării de masă, dar unii pacienți au murit din cauza nivelurilor toxice de litiu..
Compusul are aplicații farmacologice ca antimaniaci, care sunt agenți utilizați pentru tratarea tulburărilor bipolare sau a maniei asociate cu alte tulburări afective..
Corpul uman conține în mod normal aproximativ 7 miligrame de litiu la un moment dat..
Litiul apare în mod natural la plante, deoarece organismele folosesc substanța pentru a stimula creșterea.
Referințe
- Dye, J. L. (2017, 23 ianuarie). Litiu (Li). Recuperat de la britannica: britannica.com.
- EMBL-EBI. (2009, 23 noiembrie). clorură de litiu. Recuperat de la ChEBI: ebi.ac.uk.
- CLORURA DE LITIU. (S.F.). Recuperat de la CAMEO: cameochemicals.noaa.gov.
- Fișă tehnică de securitate a clorurii de litiu. (2013, 21 mai). Recuperat de la sciencelab.com.
- Centrul Național pentru Informații despre Biotehnologie ... (2005, 26 martie). Baza de date compusă PubChem; CID = 433294. Adus de la PubChem.
- Institutul Național pentru Securitate și Sănătate în Muncă. (2015, 22 iulie). CLORURA DE LITIU. Recuperat de pe cdc.gov.
- Winter, M. (S.F.). Litiu: clorură de litiu. Recuperat din elemente web.

Nimeni nu a comentat acest articol încă.