
Structura clorurii de sodiu (NaCl), proprietăți, utilizări
clorura de sodiu, De asemenea, numită sare obișnuită sau sare de masă, este o sare anorganică binară a metalului alcalin de sodiu și a clorului halogen. Este cea mai mare componentă a sării comestibile și forma sa minerală este cunoscută sub numele de halită. Formula sa moleculară este NaCI și descrie raportul stoichiometric al ionilor săi (Na+ Cl-) și nu a unei molecule discrete (Na-Cl)
Clorura de sodiu este un solid cristalin alb care se formează prin combinația de sodiu, un metal alb argintiu, care reacționează violent cu apa și elementul clor, un gaz otrăvitor, coroziv și verde pal..

O porțiune din cristale de NaCI este prezentată în imaginea superioară. Cum este posibil ca două elemente la fel de periculoase ca Na și ClDouă, se poate forma o sare comestibilă? În primul rând, ecuația chimică pentru formarea sa este:
2Na (s) + ClDouă(g) => 2NaCl (s)
Răspunsul constă în natura legăturii din NaCl. Fiind ionice, proprietățile Na+ și Cl- sunt diagonal diferiți de atomii lor neutri.
Sodiul este un element vital, dar în forma sa ionică. Apoi o+ este principalul cation extracelular cu o concentrație de aproximativ 140 mEq / l și împreună cu anionii însoțitori, Cl- și HCO3- (bicarbonat), sunt în principal responsabili pentru valoarea osmolarității și a volumului extracelular.
Mai mult, Na+ este responsabil pentru generarea și conducerea impulsului nervos în axonii neuronali, precum și pentru inițierea contracției musculare.
NaCl a fost folosit din cele mai vechi timpuri pentru aromatizarea alimentelor și pentru conservarea cărnii, datorită capacității sale de a ucide bacteriile și de a preveni deteriorarea.
De asemenea, este necesar pentru producerea de hidroxid de sodiu (NaOH) și clor molecular (ClDouă), reacționând NaCl cu apă sub hidroliză:
2HDouăO (l) + 2 NaCI (s) => 2NaOH (aq) + ClDouă(g) + HDouă(g)
În catod (-) se acumulează HDouă (g) și NaOH. Între timp, în anod (+) Cl se acumuleazăDouă (g). Hidroxidul de sodiu este utilizat la fabricarea săpunurilor și a clorului la fabricarea plasticului din PVC.
Indice articol
- 1 Structura clorurii de sodiu
- 1.1 Celula unitară
- 2 Proprietăți
- 2.1 Formula moleculară
- 2.2 Greutate moleculară
- 2.3 Descrierea fizică
- 2.4 Culoare
- 2.5 Aromă
- 2.6 Punctul de fierbere
- 2.7 Punctul de topire
- 2.8 Solubilitatea în apă
- 2.9 Solubilitate în solvenți organici
- 2.10 Densitate
- 2.11 Presiunea vaporilor
- 2.12 Stabilitate
- 2.13 Descompunerea
- 2.14 Vâscozitatea
- 2.15 Coroziune
- 2,16 pH
- 3 utilizări
- 3.1 În alimente
- 3.2 Utilizări industriale
- 3.3 Acasă
- 3.4 Alte utilizări
- 3.5 Utilizări terapeutice
- 4 Toxicitate
- 4.1 Ingerare
- 4.2 Iritarea și contactul fizic
- 5 Referințe
Structura clorurii de sodiu
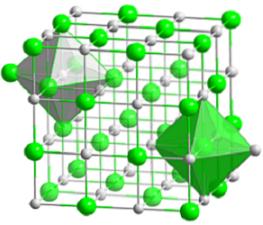
Imaginea superioară reprezintă structura cubică compactă a clorurii de sodiu. Voluminosele sfere verzi corespund anionilor Cl-, în timp ce cele albe, către cationii Na+. Observați cum cristalul NaCl constă dintr-o rețea de ioni dispuși prin interacțiunile lor electrostatice într-un raport 1: 1..
Deși bare sunt afișate în imagine, legăturile nu sunt covalente, ci ionice. Utilizarea barelor este utilă atunci când se arată geometria coordonării în jurul unui ion. De exemplu, în cazul NaCl fiecare Na+ este înconjurat de șase Cl- (octaedru alb) și fiecare Cl- din șase Na+ (octaedru verde).
Prin urmare, are o coordonare (6,6) ale cărei numere indică câte vecini înconjoară fiecare ion. Numărul din dreapta indică vecinii Na+, în timp ce cel din stânga, cei din Cl-.
Alte reprezentări omit utilizarea barelor pentru a evidenția găurile octaedrice din structură, care rezultă din spațiul interstițial dintre șase anioni Cl.- (sau cationi Na+) ambalate. Acest aranjament este observat în alte săruri anorganice mono (MX) sau poliatomice și se numește sare gem.
Celula unitară
Celula unitară a sării de rocă este cubică, dar care cuburi o reprezintă exact în imaginea de mai sus? Octaedrele dau răspunsul. Ambele acoperă o celulă totală formată din patru cuburi mici.
Acești cuburi au porțiuni ale ionilor la vârfurile, marginile și fețele lor. Privind atent, un ion Na+ este situat în centru și douăsprezece dintre ele pe margini. Un ion pe o margine poate fi împărțit de patru cuburi. Deci există 4 ioni Na+ (12 × 1/4 + 1 = 4).
Pentru ioni Cl-, opt sunt situate la vârfuri și șase la margini. Deoarece ionii poziționați la vârfuri împart spațiul cu alți opt cuburi, iar la margini cu șase, avem 4 ioni Cl- (8 × 1/8 + 6 × 1/2 = 4).
Rezultatul de mai sus este interpretat după cum urmează: în celula unitară a NaCl există patru cationi Na+ și patru anioni Cl-; proporție care este de acord cu formula chimică (un Na+ pentru fiecare Cl-).
Proprietăți
Formulă moleculară
NaCI.
Greutate moleculară
58,44 g / mol.
Descriere Fizica
Un solid cristalin.
Culoare
Cristale incolore transparente sau pulbere cristalină albă.
Gust
Sărat.
Punct de fierbere
2.575ºF la 760 mmHg.
1.465 ºC.
Punct de topire
1.474 ºF (800,7 ºC).
Atât punctul de fierbere, cât și punctul de topire reflectă căldura necesară pentru a depăși energia rețelei cristaline. Prin urmare, aceste măsurători confirmă caracterul ionic al NaCl..
Solubilitatea apei
Mai mare sau egal cu 100 mg / ml la 68 ° F.
36,0 g / 100 ml la 25 ° C.
Este de fapt o sare higroscopică, care reține umiditatea din mediu.
Solubilitate în solvenți organici
0,065 g / 100 ml etanol la 25 ° C; 10 g / 100 g glicerol la 25 ° C; 2,15 g / 100 ml de amoniac lichid la 40 ° C; 1,4 g / 100 ml de metanol la 25 ° C; 7,15 g / 100 etilen glicol la 25 ° C și 5,21 g / 100 g acid formic la 25 ° C.
Densitate
2,165 g / cm3 la 77 ° C.
Presiunea de vapori
1 mmHg la 1.589ºF.
Stabilitate
Stabil în condițiile de depozitare recomandate.
Descompunere
Când este încălzit la temperaturi ridicate, acesta se descompune, emițând vapori de acid clorhidric și oxid de disodiu..
Viscozitate
Vâscozitatea soluțiilor saturate 1,93 mPa-s.
Coroziune
Este coroziv pentru multe metale.
pH
6,7 până la 7,3 în soluție apoasă.
Aplicații
În mâncare
-Clorura de sodiu a fost utilizată din cele mai vechi timpuri pentru a îmbunătăți gustul alimentelor și pentru a le conserva. Sarea cărnii este o modalitate de a o păstra de acțiunea bacteriană, deoarece întârzie descompunerea proteinelor.
-Pe de altă parte, sarea mărește osmolaritatea în jurul cărnii, ceea ce determină absorbția prin osmoză a apei bacteriilor, determinând eliminarea acesteia.
Utilizări industriale
Industria alimentară
-În industria alimentară, sarea este utilizată ca intensificator de aromă, aditiv de control al fermentației, agent de control al texturii și dezvoltator de culoare. De exemplu, se adaugă sare pentru a scoate culoarea în slănină, șuncă și alte produse din carne..
-Sarea servește ca liant în prepararea cârnaților. Contribuie la formarea unui gel liant compus din carne, grăsime și umiditate.
-În procesarea făinii pentru fabricarea pâinii, se adaugă sare în timpul coacerii pentru a controla rata de dospire a aluatului de pâine. Este, de asemenea, utilizat pentru întărirea glutenului și ca un potențiator de aromă, precum și pentru umplerea produselor coapte.
-Se utilizează la fabricarea cerealelor pentru micul dejun, a făinurilor mixte sau preparate, a cartofilor prăjiți, a alimentelor pentru câini și pisici etc..
Sinteza substanțelor chimice
-Clorura de sodiu este utilizată ca materie primă în producția de hidroxid de sodiu și clor, care, la rândul său, sunt utile în multe industrii chimice.
-Sarea este utilizată în prelucrarea diferitelor metale, de exemplu aluminiu, cupru, oțel și vanadiu. De asemenea, este utilizat pentru a produce clorat de sodiu, care este utilizat ulterior în sinteza dioxidului de clor, un înălbitor pe bază de oxigen. Dioxidul de clor este mai puțin dăunător pentru mediu decât alte înălbitori.
În industria pielăriei
-Sarea este utilizată pentru a inhiba acțiunea bacteriană din interiorul pielii, precum și pentru a ajuta la rehidratarea acesteia.
În industria textilă
-Sarea este utilizată ca mordant în vopsirea țesăturilor. Se utilizează ca clătire cu saramură pentru a îndepărta contaminanții organici și pentru a crea o încărcătură pozitivă pe suprafața țesăturilor care permite lipirea coloranților încărcați negativ.
În industria petrolieră
-În explorarea petrolului și a gazelor, sarea este o componentă importantă a fluidelor de forare a puțurilor. Se folosește pentru a flocula și a crește densitatea lichidelor de foraj, ceea ce permite depășirea presiunilor mari de gaz din puțurile care trebuie atinse. În plus, sarea menține saturația lichidului de foraj.
-Sarea ajută la compactarea solului pe care sunt construite drumurile. Reduce deplasarea subterană cauzată de modificările de umiditate și traficul auto.
In casa
Sarea a fost folosită prin frecare în curățarea suprafețelor, oalelor și tigăilor. De asemenea, în prevenirea mucegaiului și ca agent de îndepărtare a petelor. Este, de asemenea, utilizat în multe mărci de șampon și pastă de dinți..
Alte utilizări
Pe drumuri
-În așteptarea căderii de zăpadă, drumurile sunt acoperite cu saramură, ceea ce împiedică legarea gheții de suprafața drumului. Pentru dezgheț, se utilizează un amestec de saramură și sare și uneori se adaugă alte componente chimice, cum ar fi magneziu sau clorură de calciu. Utilizarea sării și a saramurii nu este eficientă la temperaturi sub -10 ° C.
Adăugarea de sare produce o scădere a punctului crioscopic, o proprietate coligativă a soluțiilor, împiedicând astfel formarea de gheață într-un anumit mod..
-Datorită stării sale higroscopice, sarea este utilizată ca un desicant ieftin.
În rășini utilizate pentru a înmuia apa
Apa dură conține ioni de calciu și magneziu care împiedică acțiunea săpunului și provoacă depuneri de materiale alcaline pe diverse echipamente și conducte. La dedurizarea apei se folosesc rășini schimbătoare de ioni. Sarea este utilizată la prepararea și regenerarea rășinilor.
La stingătoarele de incendiu
Clorura de sodiu este utilizată în stingătoarele de incendiu pentru combaterea incendiilor în care sunt prezente metale combustibile, cum ar fi aliajele de magneziu, potasiu, sodiu și NK..
Sarea acționează ca un radiator și formează, de asemenea, o crustă care restricționează accesul oxigenului la foc..
În pahare
Cristalele de clorură de sodiu sunt utilizate în componente optice, cum ar fi ferestrele și prismele, în special pentru lumina infraroșie. Cu toate acestea, deoarece sarea este foarte higroscopică, se produce un fel de îngheț care acoperă lentilele. Din acest motiv, lentilele cu clorură de sodiu au fost înlocuite cu lentile cu selenură de zinc (ZnSe)..
Utilizări terapeutice
Compensați lipsa sărurilor din corp
-Când există o epuizare corporală a Na+, trebuie înlocuit pentru a menține osmolaritatea extracelulară, conducerea nervului și contracția musculară.
-NaCl este utilizat în tratamentul și prevenirea deficitului de sodiu și clor, rezultat din transpirația excesivă în timpul expunerii la temperaturi ridicate. Este, de asemenea, utilizat într-o diureză excesivă sau o restricție excesivă a aportului de ser fiziologic.
-Administrarea parenterală a unei soluții de NaCl 045% este utilizată în tratamentul diabetului hiperosmolar. Îndeplinește o funcție de rehidratare și servește pentru a evalua starea funcției renale.
-Injecții de soluții hipertonice, cu o concentrație de NaCl mai mare de 0,9% g / v,
-Acestea sunt utilizate atunci când există o epuizare severă a Na+, fiind o restaurare a ionului esențial. Această hiponatremie poate fi consecința unui tratament cu electroliți liberi sau cu o concentrație de Na+.
Hiponatremia poate fi cauzată și de aportul excesiv de apă, care nu este controlat de funcția renală inadecvată..
În tratamente și utilizări neconvenționale
-Soluțiile de inhalare cu NaCl sunt utilizate pentru a dilua medicamentele utilizate în timpul procesului de nebulizare. Este, de asemenea, utilizat pentru spălarea traheală și irigare. Soluție salină 0,9% utilizată în spray-urile nazale.
-Soluțiile de NaCl 20% sunt utilizate pentru instalarea transabdominală intraamniotică, inducând astfel un avort tardiv în timpul celui de-al doilea trimestru de sarcină..
-Clorura de sodiu poate fi utilizată ca antiseptic local. Datorită capacității sale osmotice, este capabil să deshidrateze un spectru larg de viruși și bacterii într-o stare non-spurată; de aceea, este folosit ca antiseptic dureros pentru dezinfectarea rănilor.
Toxicitate
Ingerare
Are un efect dăunător asupra sănătății numai dacă aportul este mare și pentru o lungă perioadă de timp. În aceste condiții, hipernatremia ar apărea cu creșterea consecutivă a volumului extracelular care ar duce la hipertensiune arterială..
Iritare și contact fizic
Are efect toxic numai dacă inhalarea este foarte mare. Contactul excesiv cu pielea poate determina uscarea acestuia. În cele din urmă, provoacă o iritație momentană la contactul cu ochii.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (Ediția a patra., Pp. 84, 90, 93, 263). Mc Graw Hill.
- Whitten, Davis, Peck și Stanley. Chimie. (Ed. A VIII-a). CENGAGE Learning, p. 482-483.
- Clorura de sodiu. (2018). Clorură de sodiu: beneficii, utilizări, proprietăți, riscuri. Preluat din: clorură de sodiu.org
- PubChem. (2018). Clorura de sodiu. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Clorura de sodiu. Luat de pe: en.wikipedia.org
- Elemente americane. (2018). Clorura de sodiu. Luat de pe: americanelements.com



Nimeni nu a comentat acest articol încă.