
Expresia concentrației chimice, unități, molaritate

concentrația chimică este măsura numerică a cantității relative de solut într-o soluție. Această măsură exprimă un raport dintre solut și o cantitate sau volum de solvent sau soluție în unități de concentrație. Termenul „concentrație” este legat de cantitatea de dizolvat prezent: o soluție va fi mai concentrată cu cât are mai mult dizolvat.
Aceste unități pot fi fizice atunci când se iau în considerare mărimile de masă și / sau volum ale soluției sau ale componentelor chimice, atunci când concentrația solutului este exprimată în termeni de moli sau echivalenți ai acestuia, luând ca referință numărul lui Avogadro..

Astfel, prin utilizarea greutăților moleculare sau atomice și a numărului lui Avogadro, este posibil să se convertească unități fizice în unități chimice atunci când se exprimă concentrația unui solut dat. Prin urmare, toate unitățile pot fi convertite pentru aceeași soluție.
Indice articol
- 1 Soluții diluate și concentrate
- 2 Moduri de exprimare a concentrării
- 2.1 Descriere calitativă
- 2.2 Clasificarea după solubilitate
- 2.3 Notatia cantitativa
- 3 unități de concentrare
- 3.1 Unități de concentrație relativă
- 3.2 Unități de concentrație diluată
- 3.3 Unități de concentrație în funcție de aluni
- 3.4 Formalitate și normalitate
- 4 Molaritatea
- 4.1 Exercițiul 1
- 4.2 Exercițiul 2
- 5 Normalitatea
- 5.1 Calcul
- 5.2 Exercițiul 1
- 6 Molalitatea
- 6.1 Exercițiul 1
- 7 Note importante și recomandări privind concentrarea chimică
- 7.1 Volumul soluției este întotdeauna mai mare decât cel al solventului
- 7.2 Utilitatea molarității
- 7.3 Formulele nu sunt memorate, dar unitățile sau definițiile sunt
- 8 Referințe
Soluții diluate și concentrate
Cum vă puteți da seama dacă o concentrație este foarte diluată sau concentrată? La prima vedere prin manifestarea oricăreia dintre proprietățile sale organoleptice sau chimice; adică cele pe care simțurile le percep sau care pot fi măsurate.
Imaginea de mai sus prezintă o diluare a unei concentrații de dicromat de potasiu (KDouăCrDouăSAU7), care prezintă o culoare portocalie. De la stânga la dreapta puteți vedea cum culoarea își scade intensitatea pe măsură ce concentrația se diluează, adăugând mai mult solvent.
Această diluție face posibilă obținerea în acest mod a unei concentrații diluate dintr-o concentrată. Culoarea (și alte proprietăți „ascunse” din miezul său portocaliu) se schimbă la fel ca și concentrația sa, fie cu unități fizice, fie chimice..
Dar care sunt unitățile chimice de concentrație? Printre acestea se numără molaritatea sau concentrația molară a unei soluții, care leagă moli de dizolvat de volumul total al soluției în litri..
Există, de asemenea, molalitatea sau, de asemenea, numită concentrație molară, care se referă la moli de dizolvat, dar care sunt conținute într-o cantitate standardizată de solvent sau solvent care este exact un kilogram.
Acest solvent poate fi pur sau dacă soluția conține mai mult de un solvent, molalitatea va fi moli de solut pe kilogram de amestec de solvent..
Și a treia unitate de concentrație chimică este normalitatea sau concentrația normală a unei soluții care exprimă numărul de echivalenți chimici ai solutului pe litru de soluție.
Unitatea în care se exprimă normalitatea este în echivalenți pe litru (Eq / L), iar în medicină concentrația de electroliți din serul uman este exprimată în miliechivalenți pe litru (mEq / L).
Modalități de exprimare a concentrării

Concentrația unei soluții poate fi notată în trei moduri principale, chiar dacă acestea au o mare varietate de termeni și unități în sine, care pot fi utilizate pentru a exprima măsura acestei valori: descriere calitativă, notație cantitativă și clasificare în termeni solubilitate.
În funcție de limba și contextul în care lucrați, va fi ales unul dintre cele trei moduri de exprimare a concentrației unui amestec.
Descriere calitativă
Utilizată în principal în limbajul informal și non-tehnic, descrierea calitativă a concentrației unui amestec este exprimată sub formă de adjective, care indică într-un mod generalizat nivelul de concentrație pe care îl are o soluție.
În acest fel, nivelul minim de concentrație conform descrierii calitative este cel al unei soluții „diluate”, iar maximul este cel al „concentrat”..
Vorbim de soluții diluate atunci când o soluție are o proporție foarte mică de substanță dizolvată în funcție de volumul total al soluției. Dacă doriți să diluați o soluție, trebuie să adăugați mai mult solvent sau să găsiți o modalitate de a reduce solutul.
Acum, vorbim de soluții concentrate atunci când au o proporție mare de solut în funcție de volumul total al soluției. Pentru a concentra o soluție trebuie să adăugați mai mult solut sau să reduceți cantitatea de solvent.
În acest sens, această clasificare se numește descriere calitativă, nu numai pentru că îi lipsesc măsurătorile matematice, ci și datorită calității empirice (poate fi atribuită trăsăturilor vizuale, mirosurilor și gusturilor, fără a fi nevoie de teste științifice)..
Clasificare după solubilitate
Solubilitatea unei concentrații denotă capacitatea maximă de soluție pe care o soluție o are, în funcție de condiții precum temperatura, presiunea și substanțele care sunt dizolvate sau în suspensie..
Soluțiile pot fi clasificate în trei tipuri în funcție de nivelul lor de dizolvat dizolvat în momentul măsurării: soluții nesaturate, saturate și suprasaturate.
- Soluțiile nesaturate sunt cele care conțin mai puțin solut decât soluția se poate dizolva. În acest caz, soluția nu a atins concentrația maximă.
- Soluțiile saturate sunt cele în care cantitatea maximă de dizolvat posibil s-a dizolvat în solvent la o temperatură specifică. În acest caz există un echilibru între ambele substanțe și soluția nu poate accepta mai mult solut (deoarece va precipita).
- Soluțiile suprasaturate au mai mult solut decât ar accepta soluția în condiții de echilibru. Acest lucru se realizează prin încălzirea unei soluții saturate, adăugând mai mult solut decât în mod normal. Odată rece, nu va precipita automat dizolvatul, dar orice perturbare poate provoca acest efect datorită instabilității sale..
Notatie cantitativa
Atunci când se studiază o soluție care urmează să fie utilizată în domeniul tehnic sau științific, este necesară o precizie măsurată și exprimată în unități, care descrie concentrația în funcție de valorile sale exacte de masă și / sau volum..
Acesta este motivul pentru care există o serie de unități utilizate pentru a exprima concentrația unei soluții în notația sa cantitativă, care sunt împărțite în fizice și chimice și care la rândul lor au propriile lor subdiviziuni.
Unitățile de concentrații fizice sunt cele de „concentrație relativă”, care sunt exprimate în termeni de procente. Există trei moduri de a exprima concentrații procentuale: procente de masă, procente de volum și procente de masă-volum..
În schimb, unitățile de concentrații chimice se bazează pe cantități molare, echivalenți gram, părți pe milion și alte caracteristici ale substanței dizolvate în raport cu soluția..
Aceste unități sunt cele mai frecvente datorită preciziei lor ridicate la măsurarea concentrațiilor și, din acest motiv, sunt de obicei cele pe care doriți să le cunoașteți pentru a lucra cu soluții chimice..
Unități de concentrare
După cum sa descris în secțiunile anterioare, atunci când se caracterizează cantitativ concentrația unei soluții, calculele trebuie să fie guvernate de unitățile existente în acest scop..
În mod similar, unitățile de concentrație sunt împărțite în cele de concentrație relativă, cele de concentrații diluate, cele bazate pe aluniți și altele suplimentare..
Unități de concentrație relativă
Concentrațiile relative sunt cele exprimate în procente, după cum s-a menționat în secțiunea anterioară. Aceste unități sunt împărțite în procente masă-masă, procent volum-volum și procente masă-volum și sunt calculate după cum urmează:
- % masă = masa soluției (g) / masa soluției totale (g) x 100
- % volum = volum de dizolvat (ml) / volum de soluție totală (ml) x 100
- % masă / volum = masa soluției (g) / volumul soluției totale (ml) x 100
În acest caz, pentru a calcula masa sau volumul soluției totale, masa sau volumul soluției trebuie adăugate cu cea a solventului..
Unități de concentrație diluată
Unitățile de concentrație diluate sunt cele utilizate pentru a exprima acele concentrații foarte mici care se găsesc sub formă de urme într-o soluție diluată; cea mai obișnuită utilizare pentru aceste unități este de a găsi urme ale unui gaz dizolvat în altul, cum ar fi agenți care poluează aerul.
Aceste unități sunt indicate sub formă de părți pe milion (ppm), părți pe miliard (ppb) și părți pe bilion (ppt) și sunt exprimate după cum urmează:
- ppm = 1 mg soluție / 1 L soluție
- ppb = 1 μg soluție / 1 L soluție
- ppt = 1 ng soluție / 1 L soluție
În aceste expresii, mg este egal cu miligrame (0,001 g), μg este egal cu micrograme (0,000001 g), iar ng este egal cu nanogramele (0,000000001 g). Aceste unități pot fi exprimate și în funcție de volum / volum.
Unități de concentrare în funcție de alunițe
Unitățile de concentrație bazate pe aluni sunt cele ale fracției molare, procentului molar, molarității și molalității (ultimele două sunt descrise mai bine la sfârșitul articolului).
Fracția molară a unei substanțe este fracția tuturor moleculelor sale constitutive (sau a atomilor) în funcție de moleculele totale sau atomii. Se calculează după cum urmează:
XLA = numărul de moli de substanță A / numărul total de moli în soluție
Această procedură se repetă pentru celelalte substanțe în soluție, luând în considerare faptul că suma lui XLA + XB + XC ... trebuie să fie egal cu unul.
Procentul de aluni este lucrat într-un mod similar cu XLA, doar ca procent:
Procentul molar al lui A = XLA x 100%
Secțiunea finală va discuta în detaliu molaritatea și molalitatea..
Formalitate și normalitate
În cele din urmă, există două unități de concentrare care sunt în prezent în desuetudine: formalitate și normalitate..
Formalitatea unei soluții reprezintă numărul de greutate-formula-gram pe litru de soluție totală. Se exprimă ca:
F = Nu. Soluție P.F.G / L
În această expresie P.F.G este egal cu greutatea fiecărui atom al substanței, exprimată în grame.
În schimb, normalitatea reprezintă numărul de echivalenți de solut împărțit la litri de soluție, așa cum se exprimă mai jos:
N = grame echivalente de soluție dizolvată / L
În această expresie, gramele echivalente de substanță dizolvată pot fi calculate prin numărul de moli H+, Oh- sau alte metode, în funcție de tipul moleculei.
Molaritatea
Molaritatea sau concentrația molară a unui dizolvat este unitatea de concentrație chimică care exprimă sau relaționează molii solutului (n) care sunt conținute într-un (1) litru (L) de soluție.
Molaritatea este desemnată prin litera majusculă M și pentru a determina moli ale substanței dizolvate (n), gramele solutului (g) sunt împărțite la greutatea moleculară (MW) a substanței dizolvate..
La fel, greutatea moleculară MW a solutului este obținută din suma greutăților atomice (PA) sau a masei atomice a elementelor chimice, având în vedere proporția în care se combină pentru a forma solutul. Astfel, diferite soluții au propriul PM (deși acest lucru nu este întotdeauna cazul).
Aceste definiții sunt rezumate în următoarele formule care sunt utilizate pentru a efectua calculele corespunzătoare:
Molaritate: M = n (moli de dizolvat) / V (litru de soluție)
Numărul de moli: n = g de dizolvat / MW de dizolvat
Exercitiul 1
Calculați molaritatea unei soluții care este preparată cu 45 g de Ca (OH)Două dizolvat în 250 ml de apă.
Primul lucru de calculat este greutatea moleculară a Ca (OH)Două (hidroxid de calciu). Conform formulei sale chimice, compusul este alcătuit dintr-un cation de calciu și doi anioni hidroxil. Aici greutatea unui electron mai mică sau suplimentară față de specie este neglijabilă, deci se iau greutățile atomice:
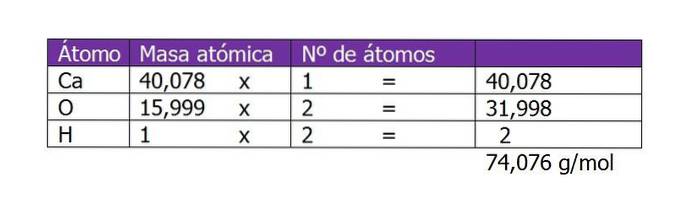
Numărul de moli al dizolvatului va fi apoi:
n = 45 g / (74 g / mol)
n = 0,61 moli de Ca (OH)Două
Se obțin 0,61 moli de substanță dizolvată, dar este important să ne amintim că acești moli se dizolvă în 250 ml de soluție. Deoarece definiția molarității este aluniți într-un litru sau 1000 mL, trebuie făcută o regulă simplă de trei pentru a calcula moli care sunt în 1000 mL din soluția menționată
Dacă în 250 ml soluție există => 0,61 moli de substanță dizolvată
În 1000 mL de soluție => x Câți moli sunt acolo?
x = (0,61 mol) (1000 ml) / 250 ml
X = 2,44 M (mol / L)
Altă cale
Cealaltă modalitate de a obține alunițele pentru a aplica formula necesită ca cei 250 ml să fie luați în litri, aplicând, de asemenea, o regulă de trei:
Dacă 1000 ml => sunt 1 litru
250 ml => x Câți litri sunt?
x = (250 mL) (1 L) / 1000 mL
x = 0,25 L
Înlocuind apoi formula Molarity:
M = (0,61 mol solut) / (0,25 L soluție)
M = 2,44 mol / L
Exercițiul 2
Ce înseamnă pentru o soluție de HCI să fie 2,5 M?
Soluția de HCI este de 2,5 moli, adică un litru de ea a dizolvat 2,5 moli de acid clorhidric..
Normal
Normalitatea sau concentrația echivalentă este unitatea de concentrație chimică a soluțiilor care este desemnată cu litera majusculă N. Această unitate de concentrație indică reactivitatea substanței dizolvate și este egală cu numărul de echivalenți ai substanței dizolvate (Eq) dintre volumul soluției exprimat în litri.
N = Eq / L
Numărul de echivalenți (Eq) este egal cu gramele de dizolvat împărțit la greutatea echivalentă (PEq).
Eq = g dizolvat / PEq
Greutatea echivalentă, sau cunoscută și sub denumirea de echivalent gram, se calculează prin obținerea greutății moleculare a solutului și împărțirea acestuia la un factor echivalent care, în scopul rezumării în ecuație, se numește delta zeta (ΔZ).
PEq = PM / ΔZ
Calcul
Calculul normalității va avea o variație foarte specifică a factorului echivalent sau ΔZ, care depinde și de tipul de reacție chimică la care participă specia dizolvată sau reactivă. Unele cazuri ale acestei variații pot fi menționate mai jos:
-Când vine vorba de un acid sau o bază, ΔZ sau factorul echivalent, va fi egal cu numărul de ioni de hidrogen (H+) sau hidroxil OH- care are solutul. De exemplu, acidul sulfuric (HDouăSW4) are doi echivalenți deoarece are doi protoni acizi.
-Când vine vorba de reacții de reducere a oxidării, ΔZ va corespunde numărului de electroni implicați în procesul de oxidare sau reducere, în funcție de caz. Aici intră în joc echilibrarea ecuațiilor chimice și specificația reacției..
-La fel, acest factor echivalent sau ΔZ va corespunde numărului de ioni care precipită în reacțiile clasificate ca precipitații..
Exercitiul 1
Determinați normalitatea a 185 g de NaDouăSW4 găsit în 1,3 L de soluție.
Greutatea moleculară a solutului din această soluție va fi calculată mai întâi:
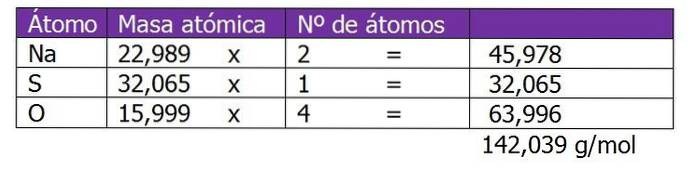
Al doilea pas este de a calcula factorul echivalent sau ΔZ. În acest caz, deoarece sulfatul de sodiu este o sare, va fi luată în considerare valența sau încărcarea cationului sau a Na de metal.+, care va fi înmulțit cu 2, care este indicele formulei chimice de sare sau solut:
N / ADouăSW4 => ∆Z = Valencia Cation x Subscript
∆Z = 1 x 2
Pentru a obține greutatea echivalentă, se înlocuiește în ecuația sa respectivă:
PEq = (142,039 g / mol) / (2 Eq / mol)
PEq = 71,02 g / echiv
Și apoi puteți continua să calculați numărul de echivalenți, recurgând din nou la un alt calcul simplu:
Eq = (185 g) / (71,02 g / Eq)
Număr de echivalenți = 2.605 echiv
În cele din urmă, cu toate datele necesare, normalitatea este acum calculată prin substituirea conform definiției sale:
N = 2,605 Eq / 1,3 L
N = 2,0 N
Molalitatea
Molalitatea este desemnată prin litera mică m y este egal cu moli de dizolvat care sunt prezenți într-un (1) kilogram de solvent. Este, de asemenea, cunoscut sub numele de concentrație molară și se calculează utilizând următoarea formulă:
m = moli de dizolvat / Kg de solvent
În timp ce Molaritatea stabilește raportul molilor de dizolvat conținut într-un (1) litru de soluție, molalitatea raportează molii de dizolvat care există într-un (1) kilogram de solvent.
În acele cazuri în care soluția este preparată cu mai mult de un solvent, molalitatea va exprima aceleași moli de solut pe kilogram de amestec de solvent..
Exercitiul 1
Determinați molalitatea unei soluții care a fost preparată prin amestecarea a 150 g zaharoză (C12H220unsprezece) cu 300 g de apă.
Greutatea moleculară a zaharozei este determinată mai întâi pentru a continua calcularea moli de solut în această soluție:
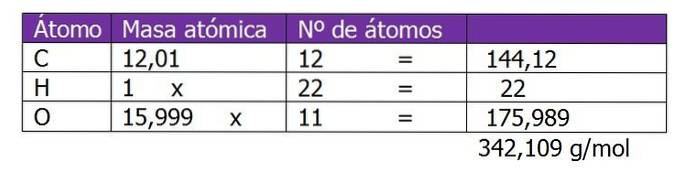
Se calculează numărul de moli de zaharoză:
n = (150g zaharoză) / (342.109 g / mol)
n = 0,448 moli de zaharoză
Apoi, gramele de solvent sunt luate în kilograme pentru a putea aplica formula finală.
Înlocuind apoi:
m = 0,448 moli de zaharoză / 0,3 kilograme de apă
m = 1,46 mol C12H220unsprezece/ Kg HDouăSAU
Deși există în prezent o dezbatere despre expresia finală a molalității, acest rezultat poate fi exprimat și ca:
1,26 m C12H220unsprezece sau 1,26 molal
Uneori se consideră avantajos să se exprime concentrația soluției în termeni de molalitate, deoarece masele solutului și solventului nu suferă fluctuații ușoare sau modificări inaparente datorită efectelor temperaturii sau presiunii; așa cum se întâmplă în soluții cu solut gazos.
În plus, se subliniază faptul că această unitate de concentrație referită la un dizolvat specific este neschimbată prin existența altor soluții în soluție..
Recomandări și note importante privind concentrația chimică
Volumul soluției este întotdeauna mai mare decât cel al solventului
Pe măsură ce exercițiile de soluție sunt rezolvate, apare eroarea de a interpreta volumul unei soluții ca și cum ar fi cel al solventului. De exemplu, dacă un gram de ciocolată pudră este dizolvat într-un litru de apă, volumul soluției nu este egal cu cel al unui litru de apă..
De ce nu? Deoarece solutul va ocupa întotdeauna spațiu între moleculele solventului. Când solventul are o afinitate mare pentru dizolvat, modificarea volumului după dizolvare poate fi neglijabilă sau neglijabilă..
Dar, dacă nu, și cu atât mai mult dacă cantitatea de solut este mare, trebuie luată în considerare modificarea volumului. Fiind astfel: Vsolvent + Vsolute = Vsolution. Numai în soluții diluate sau în care cantitățile de substanță dizolvată sunt mici este valid Vsolvent = Vsolution.
Această eroare trebuie reținută în special atunci când lucrați cu substanțe dizolvate lichide. De exemplu, dacă în loc să dizolve ciocolata pudră, mierea este dizolvată în alcool, atunci volumul de miere adăugată va avea efecte semnificative asupra volumului total al soluției..
Prin urmare, în aceste cazuri, volumul solutului trebuie adăugat la cel al solventului..
Utilitatea molarității
-Cunoașterea Molarității unei soluții concentrate permite efectuarea calculelor de diluție folosind formula simplă M1V1 = M2V2, unde M1 corespunde Molarității inițiale a soluției și M2 Molarității soluției care trebuie preparată din soluția M1.
-Cunoscând Molaritatea unei soluții, Normalitatea acesteia poate fi ușor calculată folosind următoarea formulă: Normalitatea = numărul de echivalenți x M
Formulele nu sunt memorate, dar unitățile sau definițiile sunt
Cu toate acestea, uneori memoria nu reușește să rețină toate ecuațiile relevante pentru calculele concentrației. Pentru aceasta, este foarte util să aveți o definiție foarte clară a fiecărui concept.
Din definiție, unitățile sunt scrise folosind factori de conversie pentru a le exprima pe cele care corespund ceea ce doriți să determinați.
De exemplu, dacă aveți molalitate și doriți să o convertiți la normal, procedați după cum urmează:
(mol / Kg solvent) x (kg / 1000g) (g solvent / mL) (mL solvent / ml soluție) (1000mL / L) (Eq / mol)
Rețineți că (g solvent / ml) este densitatea solventului. Termenul (ml solvent / ml soluție) se referă la cât volum de soluție corespunde de fapt solventului. În multe exerciții, acest ultim termen este egal cu 1, din motive practice, deși nu este niciodată complet adevărat..
Referințe
- Chimie introductivă- 1Sf Ediția canadiană. Unități cantitative de concentrare. Capitolul 11 Soluții. Preluat de pe: opentextbc.ca
- Wikipedia. (2018). Concentrație echivalentă. Luat de pe: en.wikipedia.org
- PharmaFactz. (2018). Ce este molaritatea? Preluat de pe: pharmafactz.com
- Whitten, Davis, Peck și Stanley. Chimie. (Ed. A VIII-a). CENGAGE Learning, p 101-103, 512, 513.
- Soluții apoase-Molaritate. Luat din: chem.ucla.edu
- Quimicas.net (2018). Exemple de normalitate. Recuperat de pe: quimicas.net.


Nimeni nu a comentat acest articol încă.