
Structura, proprietățile și utilizările deuteriului
deuteriu este una dintre speciile izotopice de hidrogen, care este reprezentat ca D sau DouăH. Mai mult, a fost numit hidrogen greu, deoarece masa sa este de două ori mai mare decât cea a protonului. Un izotop este o specie care provine din același element chimic, dar al cărui număr de masă este diferit de acesta.
Această distincție se datorează diferenței de număr de neutroni pe care o are. Deuteriul este considerat un izotop stabil și poate fi găsit în compușii hidrogenici naturali, deși într-o proporție destul de mică (mai puțin de 0,02%).
Având în vedere proprietățile sale, foarte asemănătoare cu cele ale hidrogenului obișnuit, poate înlocui hidrogenul în toate reacțiile la care participă, devenind substanțe echivalente..
Din acest motiv și din alte motive, acest izotop are un număr mare de aplicații în diferite domenii ale științei, devenind unul dintre cele mai importante.
Indice articol
- 1 Structură
- 1.1 Câteva fapte despre deuteriu
- 2 Proprietăți
- 3 utilizări
- 4 Referințe
Structura
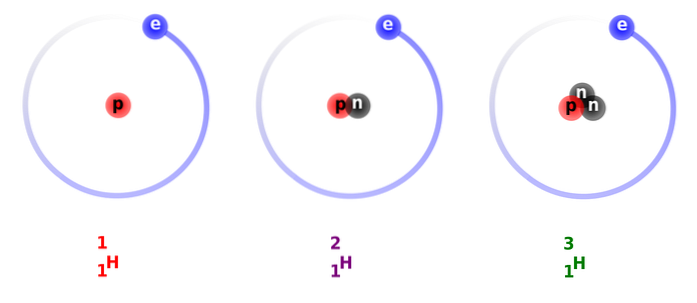
Structura deuteriului este constituită în principal dintr-un nucleu care are un proton și un neutron, cu o greutate atomică sau o masă de aproximativ 2.014 g.
În mod similar, acest izotop își datorează descoperirea lui Harold C. Urey, chimist din Statele Unite, și colaboratorilor săi Ferdinand Brickwedde și George Murphy, în 1931..
În imaginea de mai sus puteți vedea comparația dintre structurile izotopilor de hidrogen, care există sub formă de protiu (izotopul său cel mai abundent), deuteriu și tritiu, ordonate de la stânga la dreapta.
Prepararea deuteriului în stare pură a fost efectuată cu succes pentru prima dată în 1933, dar din anii 1950 s-a folosit o substanță în fază solidă și a demonstrat stabilitate, numită deuterid de litiu (LiD), pentru a înlocui deuteriul și tritiul într-un număr mare de reacții chimice.
În acest sens, abundența acestui izotop a fost studiată și s-a observat că proporția sa în apă poate varia ușor, în funcție de sursa din care este prelevată proba..
În plus, studiile de spectroscopie au determinat existența acestui izotop pe alte planete din această galaxie..
Câteva fapte despre deuteriu
După cum sa menționat mai sus, diferența fundamentală dintre izotopii de hidrogen (care sunt singurii care au fost numiți în moduri diferite) constă în structura lor, deoarece numărul de protoni și neutroni dintr-o specie îi conferă proprietățile sale chimice..
Pe de altă parte, deuteriul existent în interiorul corpurilor stelare este eliminat cu o viteză mai mare decât este originar.
În plus, se consideră că alte fenomene ale naturii formează doar o cantitate mică din ea, astfel încât producția sa continuă să genereze interes astăzi.
În mod similar, o serie de investigații au arătat că marea majoritate a atomilor care s-au format din această specie provin din Big Bang; acesta este motivul pentru care prezența sa este observată pe planete mari precum Jupiter.
Întrucât cel mai comun mod de a obține această specie în natură este atunci când se găsește în combinație cu hidrogen sub formă de protiu, relația stabilită între proporția ambelor specii în diferite domenii ale științei continuă să trezească interesul comunității științifice. precum astronomia sau climatologia.
Proprietăți
- Este un izotop lipsit de caracteristici radioactive; adică are o natură destul de stabilă.
- Poate fi folosit pentru a înlocui atomul de hidrogen în reacțiile chimice.
- Această specie prezintă un comportament diferit de hidrogenul obișnuit în reacțiile de natură biochimică..
- Când cei doi atomi de hidrogen sunt înlocuiți în apă, obținem DDouăSau, dobândind numele de apă grea.
- Hidrogenul prezent în ocean care se află sub formă de deuteriu există în proporție de 0,016% în raport cu protiul.
- În stele, acest izotop are tendința de a se contopi rapid pentru a da naștere heliului..
- DDouăO este o specie toxică, deși proprietățile sale chimice sunt foarte asemănătoare cu cele ale HDouă
- Când atomii de deuteriu sunt supuși procesului de fuziune nucleară la temperaturi ridicate, se eliberează cantități mari de energie.
- Proprietățile fizice, cum ar fi punctul de fierbere, densitatea, căldura de vaporizare, punctul triplu, printre altele, au magnitudini mai mari în moleculele de deuteriu (DDouă) decât în hidrogen (HDouă).
- Cea mai comună formă în care se găsește este legată de un atom de hidrogen, provocând deuterid de hidrogen (HD).
Aplicații
Datorită proprietăților sale, deuteriul este utilizat într-o mare varietate de aplicații în care este implicat hidrogen. Unele dintre aceste utilizări sunt descrise mai jos:
- În domeniul biochimiei, este utilizat în marcarea izotopică, care constă în „marcarea” unei probe cu izotopul selectat pentru a o urmări prin trecerea sa printr-un sistem specific..
- În reactoarele nucleare care efectuează reacții de fuziune, este utilizat pentru a reduce viteza cu care se mișcă neutronii fără absorbția ridicată a acestora pe care o prezintă hidrogenul obișnuit..
- În zona rezonanței magnetice nucleare (RMN), solvenții pe bază de deuteriu sunt utilizați pentru a obține probe de acest tip de spectroscopie fără prezența interferențelor care apar atunci când se utilizează solvenți hidrogenati..
- În domeniul biologiei, macromoleculele sunt studiate prin tehnici de împrăștiere a neutronilor, unde probele furnizate cu deuteriu sunt utilizate pentru a reduce semnificativ zgomotul în aceste proprietăți de contrast..
- În domeniul farmacologiei, substituirea deuteriului cu hidrogen este utilizată datorită efectului izotopic cinetic generat și care permite acestor medicamente să aibă un timp de înjumătățire mai lung.
Referințe
- Britannica, E. (s.f.). Deuteriu. Recuperat de la britannica.com
- Wikipedia. (s.f.). Deuteriu. Adus de pe en.wikipedia.org
- Chang, R. (2007). Chimie, ediția a IX-a. Mexic: McGraw-Hill.
- Hiperfizică. (s.f.). Abundența de deuteriu. Recuperat de la hyperphysics.phy-astr.gsu.edu
- ThoughtCo. (s.f.). Fapte deuteriu. Adus de la thoughtco.com



Nimeni nu a comentat acest articol încă.