
Diagrama Moeller în ce constă și exercițiile rezolvate
Diagrama Moeller o Metoda ploii este o metodă grafică și mnemonică pentru a învăța regula lui Madelung; adică cum se scrie configurația electronică a unui element. Se caracterizează prin trasarea diagonalelor prin coloanele orbitalelor și, urmând direcția săgeții, se stabilește ordinea corespunzătoare a acesteia pentru un atom.
În unele părți ale lumii, diagrama Moeller este, de asemenea, cunoscută sub numele de metoda ploii. Prin aceasta, o ordine este definită în umplerea orbitalelor, care sunt definite și de cele trei numere cuantice n, l Da ml.
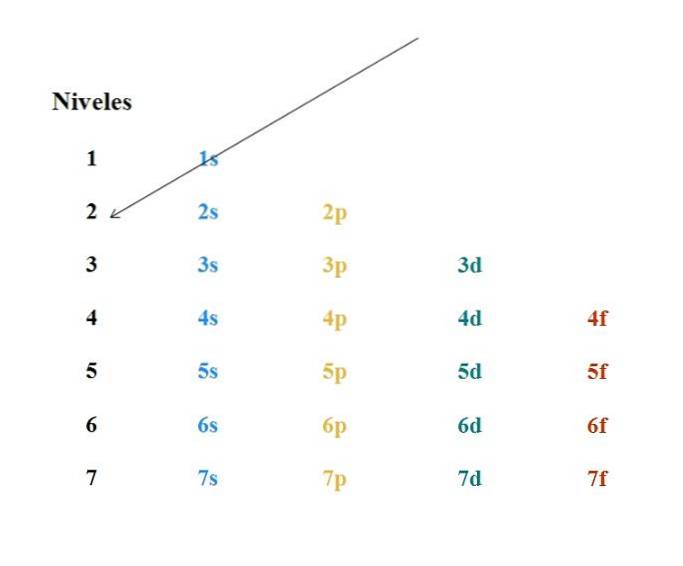
O diagramă Moeller simplă este prezentată în imaginea de mai sus. Fiecare coloană corespunde orbitalilor diferiți: s, p, d și f, cu nivelurile lor de energie respective. Prima săgeată indică faptul că umplerea oricărui atom trebuie să înceapă cu orbitalul 1s.
Astfel, următoarea săgeată trebuie să înceapă de la orbitalul 2s, apoi de la 2p până la orbitalul 3s. În acest fel, ca și cum ar fi o ploaie, orbitalele și numărul de electroni pe care le conțin (4l+Două).
Diagrama Moeller reprezintă o introducere pentru cei care studiază configurațiile electronice..
Indice articol
- 1 Ce este diagrama Moeller?
- 1.1 Regula lui Madelung
- 1.2 Pași de urmat
- 2 exerciții rezolvate
- 2.1 Beriliu
- 2.2 Fosfor
- 2.3 Zirconiu
- 2.4 Iridiu
- 2.5 Excepții de la diagrama Moeller și regula lui Madelung
- 3 Referințe
Ce este diagrama Moeller?
Regula lui Madelung
Deoarece diagrama Moeller constă dintr-o reprezentare grafică a regulii lui Madelung, este necesar să știm cum funcționează aceasta din urmă. Completarea orbitalilor trebuie să respecte următoarele două reguli:
-Orbitalii cu cele mai mici valori de n+l sunt umplute mai întâi, fiind n numărul cuantic principal și l impulsul unghiular orbital. De exemplu, orbitalul 3d corespunde n= 3 și l= 2, deci, n+l= 3 + 2 = 5; între timp, orbitalul 4s corespunde n= 4 și l= 0 și n+l= 4 + 0 = 4. Din cele de mai sus se stabilește că electronii umple mai întâi orbitalul 4s decât cel 3d.
-Dacă doi orbitali au aceeași valoare de n+l, electronii îl vor ocupa mai întâi pe cel cu cea mai mică valoare de n. De exemplu, orbitalul 3d are o valoare de n+l= 5, ca orbitalul 4p (4 + 1 = 5); dar din moment ce 3d are cea mai mică valoare de n, se va umple mai devreme de 4p.
Din cele două observații anterioare, se poate ajunge la următoarea ordine de umplere a orbitalilor: 1s 2s 2p 3s 3p 4s 3d 4p.
Urmând aceiași pași pentru valori diferite ale n+l pentru fiecare orbital se obțin configurațiile electronice ale altor atomi; care la rândul lor poate fi determinat și de diagrama Moeller grafic.
Pașii de urmat
Regula lui Madelung afirmă formula n+l, cu care configurația electronică poate fi „armată”. Cu toate acestea, după cum sa menționat, diagrama Moeller reprezintă deja grafic acest lucru; deci doar urmați coloanele sale și desenați diagonale pas cu pas.
Cum începeți atunci configurația electronică a unui atom? Pentru a face acest lucru, trebuie să cunoașteți mai întâi numărul său atomic Z, care prin definiție pentru un atom neutru este egal cu numărul de electroni.
Astfel, cu Z se obține numărul de electroni și, având în vedere acest lucru, începem să trasăm diagonale prin diagrama Moeller.
Orbitalele s pot găzdui doi electroni (aplicând formula 4l+2), p șase electroni, d zece și f paisprezece. Se oprește la orbitală unde a fost ocupat ultimul electron dat de Z.
Pentru clarificări suplimentare, mai jos sunt o serie de exerciții rezolvate.
Exerciții rezolvate
Beriliu
Folosind tabelul periodic, elementul beriliu este situat cu un Z = 4; adică cei patru electroni ai săi trebuie să fie găzduiți pe orbitali.
Începând apoi cu prima săgeată din diagrama Moeller, orbitalul 1s ocupă doi electroni: 1sDouă; urmat de orbitalul 2s, cu doi electroni suplimentari pentru a adăuga până la 4 în total: 2sDouă.
Prin urmare, configurația electronică a beriliu, exprimată ca [Be] este 1sDouă2sDouă. Rețineți că însumarea superscriptelor este egală cu numărul total de electroni.
Meci
Elementul fosfor are Z = 15 și, prin urmare, are 15 electroni în total, care trebuie să ocupe orbitalii. Pentru a avansa drumul, începeți imediat cu setarea 1sDouă2sDouă, care conține 4 electroni. Atunci ar lipsi încă 9 electroni.
După orbitalul 2s, următoarea săgeată „intră” prin orbitalul 2p, aterizând în cele din urmă în orbitalul 3s. Deoarece orbitalii 2p pot ocupa 6 electroni, iar cei 3s 2 electroni, avem: 1sDouă2sDouă2 P63sDouă.
Mai lipsesc încă 3 electroni, care ocupă următorul orbital 3p conform diagramei Moeller: 1sDouă2sDouă2 P63sDouă3p3, configurația electronică a fosforului [P].
Zirconiu
Elementul zirconiu are Z = 40. Calea de scurtare cu configurarea 1sDouă2sDouă2 P63sDouă3p6, cu 18 electroni (cel al argonului cu gaz nobil), atunci ar lipsi încă 22 de electroni. După orbitalul 3p, următorii care se completează conform diagramei Moeller sunt orbitalele 4s, 3d, 4p și 5s.
Umplându-le complet, adică 4sDouă, 3d10, 4p6 și 5sDouă, se adaugă în total 20 de electroni. Prin urmare, cei 2 electroni rămași sunt adăpostiți în următorul orbital: 4d. Astfel, configurația electronică a zirconiului, [Zr] este: 1sDouă2sDouă2 P63sDouă3p64sDouă3d104p65sDouă4dDouă.
Iridiu
Iridiul are un Z = 77, deci are 37 de electroni suplimentari comparativ cu zirconiul. Începând de la [Cd], adică 1sDouă2sDouă2 P63sDouă3p64sDouă3d104p65sDouă4d10, adăugați 29 de electroni cu următorii orbitali ai diagramei Moeller.
Desenând noi diagonale, noii orbitali sunt: 5p, 6s, 4f și 5d. Umplând primii trei orbitali complet, avem: 5p6, 6sDouă și 4f14, pentru a da în total 22 de electroni.
Deci lipsesc 7 electroni, care se află în orbitalul 5d: 1s.Două2sDouă2 P63sDouă3p64sDouă3d104p65sDouă4d105 p66sDouă4f145 zile7.
Cele de mai sus sunt configurația electronică a iridiului, [Go]. Rețineți că orbitalele 6sDouă și 5d7 sunt evidențiate cu caractere aldine pentru a indica faptul că corespund în mod corespunzător stratului de valență al acestui metal.
Excepții de la diagrama Moeller și regula lui Madelung
Există multe elemente în tabelul periodic care nu respectă ceea ce tocmai a fost explicat. Configurațiile lor de electroni diferă experimental de cele prezise din motive cuantice..
Printre elementele care prezintă aceste discrepanțe se numără: crom (Z = 24), cupru (Z = 29), argint (Z = 47), rodiu (Z = 45), ceriu (Z = 58), niobiu (Z = 41) si multe altele.
Excepțiile sunt foarte frecvente în umplerea orbitalilor d și f. De exemplu, cromul ar trebui să aibă o setare a valenței de 4sDouă3d4 în conformitate cu diagrama lui Moeller și regula lui Madelung, dar este de fapt 4s13d5.
De asemenea, și, în cele din urmă, setarea de valență argintie ar trebui să fie 5sDouă4d9; dar chiar sunt 5s14d10.
Referințe
- Gavira J. Vallejo M. (6 august 2013). Excepții de la regula lui Madelung și diagrama lui Moeller în configurația electronică a elementelor chimice. Recuperat de pe: triplenlace.com
- Superclasa mea. (s.f.) Ce este configurația electronică? Recuperat de pe: misuperclase.com
- Wikipedia. (2018). Diagrama Moeller. Recuperat de pe: es.wikipedia.org
- Manechinele. (2018). Cum se reprezintă electronii într-o diagramă a nivelului de energie. Recuperat de pe: dummies.com
- Nave R. (2016). Ordinul de umplere a statelor electronice. Recuperat de la: hyperphysics.phy-astr.gsu.edu



Nimeni nu a comentat acest articol încă.