
Structura cuaternară a proteinelor caracteristice
structura cuaternară de proteine definește relațiile spațiale dintre fiecare dintre subunitățile sale polipeptidice unite de forțe non-covalente. În proteinele polimerice, fiecare dintre lanțurile polipeptidice care o compun se numesc subunități sau protomeri.
Proteinele pot fi alcătuite din unul (monomeric), doi (dimeric), mai mulți (oligomeri) sau mulți protomeri (polimerici). Acești protomeri pot avea o structură moleculară similară sau foarte diferită. În primul caz, se spune că sunt proteine homotipice și, în al doilea caz, heterotipice.
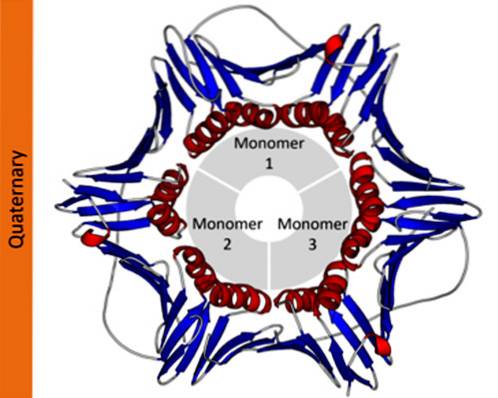
În notația științifică, biochimiștii folosesc litere grecești subindice pentru a descrie compoziția protomerilor proteinelor. De exemplu, o proteină homotipică tetramerică este desemnată ca α4, în timp ce o proteină tetramerică formată din doi dimeri diferiți este desemnată ca αDouăβDouă.
Indice articol
- 1 Structura proteinelor
- 1.1 Structura primară
- 1.2 Structura secundară
- 1.3 Structura terțiară
- 1.4 Structura cuaternară
- 2 Stabilitatea structurii cuaternare
- 2.1 Interacțiuni hidrofobe
- 2.2 Interacțiunile Van der Waals
- 2.3 Interacțiuni încărcare-încărcare
- 2.4 Legături de hidrogen
- 2.5 Interacțiunile dipolilor
- 3 Interacțiuni între protomeri
- 3.1 Interacțiuni homotipice
- 3.2 Interacțiuni heterotipice
- 4 Referințe
Structura proteinelor
Proteinele sunt molecule complexe care iau diferite configurații tridimensionale. Aceste configurații sunt unice pentru fiecare proteină și le permit să îndeplinească funcții foarte specifice. Nivelurile de organizare structurală a proteinelor sunt următoarele.
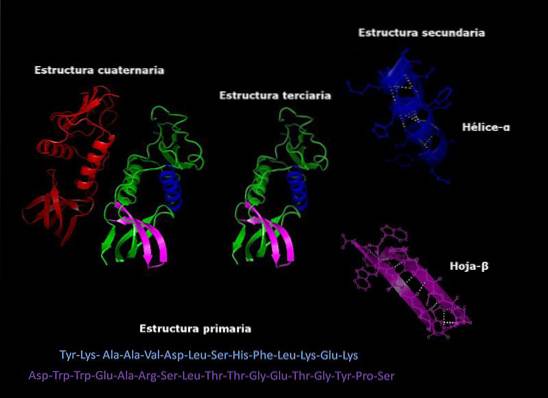
Structura primară
Se referă la secvența în care diferiții aminoacizi sunt dispuși în lanțul polipeptidic. Această secvență este dată de secvența ADN care codifică proteina menționată.
Structura secundară
Majoritatea proteinelor nu sunt lanțuri lungi de aminoacizi complet extinse, ci mai degrabă au regiuni care sunt îndoite în mod regulat în spirale sau foi. Această pliere este cea care primește numele de structură secundară.
Structura terțiară
Zonele pliate ale structurii secundare pot fi, la rândul lor, pliate și asamblate în structuri mai compacte. Acest ultim pliu este ceea ce conferă proteinei forma tridimensională..
Structura cuaternară
În proteinele care sunt alcătuite din mai multe subunități, structurile cuaternare sunt relațiile spațiale care există între fiecare subunitate, care sunt legate prin legături necovalente..
Stabilitatea structurii cuaternare
Structura tridimensională a proteinelor este stabilizată prin interacțiuni slabe sau non-covalente. În timp ce aceste legături sau interacțiuni sunt mult mai slabe decât legăturile covalente normale, ele sunt numeroase, iar efectul lor cumulativ este puternic. Aici vom vedea câteva dintre cele mai frecvente interacțiuni.
Interacțiuni hidrofobe
Unii aminoacizi conțin lanțuri laterale hidrofobe. Când proteinele au acești aminoacizi, plierea moleculei ordonează aceste lanțuri laterale spre interiorul proteinei și le protejează de apă. Natura diferitelor lanțuri laterale înseamnă că acestea contribuie în moduri diferite la efectul hidrofob..
Interacțiunile Van der Waals
Aceste interacțiuni apar atunci când moleculele sau atomii care nu sunt legați de legături covalente se apropie prea mult unul de celălalt și, din această cauză, orbitalele lor electronice exterioare încep să se suprapună..
În acel moment se stabilește o forță respingătoare între acești atomi care crește foarte rapid pe măsură ce centrele lor respective se apropie. Acestea sunt așa-numitele „forțe van der Waals”.
Interacțiuni încărcare-încărcare
Interacțiunea electrostatică are loc între o pereche de particule încărcate. În proteine, acest tip de interacțiune se produce, atât datorită încărcăturii electrice nete a proteinei, cât și a sarcinii individuale a ionilor conținuți în ea. Acest tip de interacțiune se numește uneori o punte de sare..
Legături de hidrogen
O legătură de hidrogen este stabilită între un atom de hidrogen legat covalent de o grupare donatoare de legătură de hidrogen și o pereche de electroni liberi aparținând unei grupări acceptoare de legături.
Acest tip de legătură este foarte important, deoarece proprietățile multor molecule, inclusiv cele ale apei și ale moleculelor biologice, se datorează în mare parte legăturilor de hidrogen. Împărtășește proprietățile legăturilor covalente (electronii sunt împărțiți) și, de asemenea, ale interacțiunilor non-covalente (interacțiunea încărcare-încărcare).
Interacțiuni dipolice
În moleculele, inclusiv proteinele, care nu prezintă o sarcină netă, poate apărea o aranjare neuniformă a sarcinilor lor interne, cu o extremă puțin mai negativă decât cealaltă. Aceasta este ceea ce este cunoscut sub numele de dipol.
Această stare dipolară a moleculei poate fi permanentă, dar poate fi și indusă. Dipolii pot fi atrași de ioni sau alți dipoli. Dacă dipolii sunt permanenți, interacțiunea are un domeniu de aplicare mai mare decât cel care apare cu dipolii induși.
Pe lângă aceste interacțiuni non-covalente, unele proteine oligomerice își stabilizează structura cuaternară printr-un tip de legătură covalentă, legătura disulfură. Acestea se stabilesc între grupările sulfhidril ale cisteinelor diferiților protomeri.
Legăturile disulfidice contribuie, de asemenea, la stabilizarea structurii secundare a proteinelor, dar în acest caz, ele leagă reziduurile de cisteinil în cadrul aceluiași polipeptid (legături disulfură intrapolipeptidice)..
Interacțiuni între protomeri
După cum sa menționat mai sus, în proteinele care sunt alcătuite din mai multe subunități sau protomeri, aceste subunități pot fi similare (homotipice) sau diferite (heterotipice)..
Interacțiuni homotipice
Subunitățile care alcătuiesc o proteină sunt lanțuri polipeptidice asimetrice. Cu toate acestea, în interacțiunile homotipice, aceste subunități se pot asocia în moduri diferite, realizând diferite tipuri de simetrie..
Grupurile de interacțiune ale fiecărui protomer sunt în general situate în poziții diferite, motiv pentru care sunt numite interacțiuni heteroloage. Interacțiunile heteroloage între diferitele subunități, apar uneori în așa fel încât fiecare subunitate este răsucită față de cea precedentă, putând realiza o structură elicoidală.
În alte ocazii, interacțiunile au loc în așa fel încât grupurile definite de subunități sunt dispuse în jurul uneia sau mai multor axe de simetrie, în ceea ce este cunoscut sub numele de simetrie grup-punct. Când există mai multe axe de simetrie, fiecare subunitate se rotește în raport cu vecinul său 360 ° / n (unde n reprezintă numărul de axe).
Printre tipurile de simetrie care se obțin în acest mod se numără, de exemplu, elicoidale, cubice și icosaedrice.
Când două subunități interacționează printr-o axă binară, fiecare unitate se rotește cu 180 ° față de cealaltă, în jurul acelei axe. Această simetrie este cunoscută sub numele de simetrie CDouă. În ea, site-urile de interacțiune din fiecare subunitate sunt identice; în acest caz nu vorbim de o interacțiune heterologă, ci de o interacțiune izologă.
Dacă, dimpotrivă, asocierea dintre cele două componente ale dimerului este heterologă, atunci se va obține un dimer asimetric.
Interacțiuni heterotipice
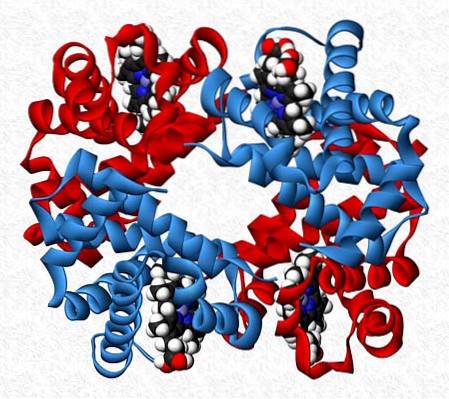
Subunitățile care interacționează într-o proteină nu sunt întotdeauna de aceeași natură. Există proteine care sunt alcătuite din douăsprezece sau mai multe subunități diferite.
Interacțiunile care mențin stabilitatea proteinei sunt aceleași ca și în interacțiunile homotipice, dar în general se obțin molecule complet asimetrice..
Hemoglobina, de exemplu, este un tetramer care are două perechi de subunități diferite (αDouăβDouă).
Referințe
- C.K. Mathews, K.E. van Holde și K.G. Ahern (2002). Biochimie. Ediția a 3-a. Benjamin / Cummings Publishing Company, Inc.
- R.K. Murray, P. Mayes, D.C. Granner și V.W. Rodwell (1996). Biochimia lui Harper. Appleton & Lange
- J.M. Berg, J.L. Tymoczko și L. Stryer (2002). Biochimie. Ediția a 5-a. W. H. Freeman and Company.
- J. Koolman și K.-H. Roehm (2005). Atlasul color al biochimiei. Ediția a II-a. Thieme.
- A. Lehninger (1978). Biochimie. Ediciones Omega, S.A.
- L. Stryer (1995). Biochimie. W.H. Freeman and Company, New York.



Nimeni nu a comentat acest articol încă.