
Structura terțiară a principalelor proteine caracteristice
structura terțiară a proteinelor Este conformația tridimensională pe care o obțin lanțurile polipeptidice atunci când se pliază pe ele însele. Această conformație apare prin interacțiuni între lanțurile laterale ale reziduurilor de aminoacizi ale polipeptidei. Lanțurile laterale pot interacționa indiferent de poziția lor în proteină.
Deoarece depinde de interacțiunile dintre grupurile R, structura terțiară prezintă aspecte nerepetitive ale lanțului, deoarece aceste grupuri sunt diferite pentru fiecare reziduu de aminoacizi. Structura secundară, pe de altă parte, depinde de grupările carboxil și amino, care sunt prezente în toți aminoacizii.
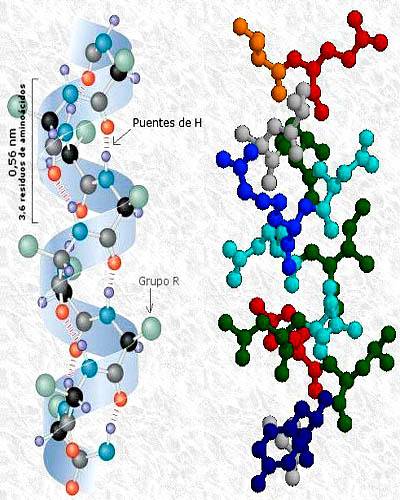
Structura terțiară a proteinei kinazei fosfatazei, cu structuri secundare în alfa helix și foaie beta. Luată și editată din: A2-33. Modificat de Alejandro Porto. [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)].
Unii autori sugerează că proteinele fibroase au o structură terțiară simplă, dar cu toate acestea, alți autori subliniază că această structură este tipică proteinelor globulare..
Indice articol
- 1 Proteine fibroase
- 1.1 α-cheratine
- 1.2 β-cheratine
- 1.3 Colagen
- 1.4 Alte proteine fibroase
- 2 Proteine globulare
- 2.1 Caracteristicile structurii terțiare a proteinelor globulare
- 2.2 Reguli generale ale plierii proteinelor globulare
- 3 Denaturarea proteinelor
- 4 Referințe
Proteine fibroase
În proteinele fibroase, lanțurile polipeptidice sunt dispuse sub formă de filamente lungi sau foi lungi; ele sunt în general alcătuite dintr-un singur tip de structură secundară. Această structură secundară este, în majoritatea cazurilor, mai importantă decât structura terțiară în determinarea formei proteinei..
Funcția sa biologică este structurală, conferind rezistență și / sau elasticitate organelor și structurilor unde se găsesc, menținându-le în același timp. Toate proteinele fibroase sunt insolubile în apă, datorită cantității mari de reziduuri de aminoacizi hidrofobi pe care le prezintă.
Aceste proteine fibroase includ cheratine și colagen. Primele se găsesc în țesuturile conjunctive și în structuri precum firele de păr, unghiile (α-cheratine), solzi și pene (β-cheratinele). Colagenul, la rândul său, se găsește printre oase, tendoane și piele.
α-cheratine
Aceste proteine fac parte din așa-numitele proteine cu filament intermediar, care joacă un rol important în citoscheletul organismelor multicelulare. În plus, acestea sunt principalul element constitutiv al părului, unghiilor, lânii, coarnelor, copitelor și una dintre principalele proteine ale pielii animalelor..
Structura moleculei este o helix α. Două catene de α-keratină pot fi aranjate în paralel și înfășurate una peste cealaltă cu grupurile lor hidrofobe R care interacționează între ele. În acest fel, se creează o structură superhelicală sau o minge cu o înfășurare cu mâna stângă..
Structura terțiară a α-cheratinei este simplă și este dominată de structura secundară a α-helixului. Pe de altă parte, structura cuaternară este de asemenea prezentă, deoarece două molecule participă la structura superhelicală, care interacționează prin legături necovalente..
β-cheratine
Structura primară este similară cu cea a α-cheratinelor, dar structura lor secundară este dominată de foi β. Ele sunt principalul constituent al solzilor de reptile și al penelor de pasăre..
Colagen
Această proteină poate reprezenta mai mult de 30% din masa proteică totală a unor animale. Se găsește în cartilaj, oase, tendoane, cornee și piele, printre alte țesuturi.
Structura secundară a colagenului este unică, fiind reprezentată de un helix stânga cu 3,3 resturi de aminoacizi pentru fiecare tură. Trei lanțuri de spirală stânga (lanțuri α) se înfășoară una pe cealaltă, oferind o moleculă supraînfășurată cu mâna dreaptă, cunoscută de unii autori ca tropocolagen..
Moleculele de tropocolagen se reunesc pentru a forma o fibră de colagen care are o rezistență ridicată, superioară celei a oțelului și comparabilă cu cea a cuprului de înaltă rezistență.
Alte proteine fibroase
Alte tipuri de proteine fibroase sunt fibroina și elastina. Prima este formată din foi β, formate în principal din glicină, alanină și serină..
Lanțurile laterale ale acestor aminoacizi sunt de dimensiuni mici, astfel încât pot fi ambalate strâns. Rezultatul este o fibră foarte rezistentă și foarte puțin extensibilă..
La elastină, la rândul său, valina înlocuiește serina printre aminoacizii săi principali. Spre deosebire de fibroină, elastina este foarte extensibilă, de unde și numele său. În constituirea moleculei, acționează și lizina, care poate participa la legături încrucișate care permit elastinei să-și recapete forma atunci când încetează tensiunea.
Proteine globulare
Proteinele globulare, spre deosebire de cele fibroase, sunt solubile și au în general mai multe tipuri de structuri secundare. Cu toate acestea, în acestea, conformațiile tridimensionale pe care le dobândesc atunci când se pliază pe ele însele sunt mai importante (structura terțiară).
Aceste conformații tridimensionale particulare conferă fiecărei proteine activitate biologică specifică. Funcția principală a acestor proteine este reglatoare, la fel ca și în cazul enzimelor.
Caracteristicile structurii terțiare a proteinelor globulare
Structura terțiară a proteinelor globulare are câteva caracteristici importante:
- Proteinele globulare sunt compacte datorită împachetării prin plierea lanțului polipeptidic.
- Reziduurile de aminoacizi îndepărtate din structura primară a lanțurilor polipeptidice rămân apropiate, putând interacționa între ele datorită plierii.
- Proteinele globulare mai mari (mai mult de 200 de aminoacizi) pot avea mai multe segmente compacte, independente una de alta și cu funcții particulare, iar fiecare dintre aceste segmente se numește domeniu. Un domeniu poate avea între 50 și 350 de reziduuri de aminoacizi.
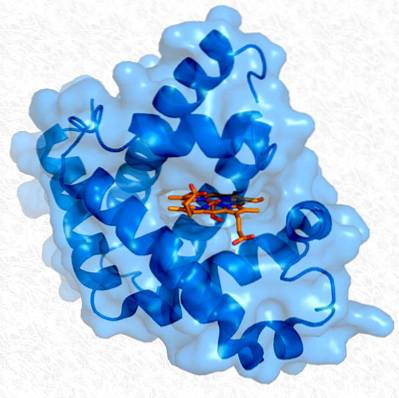
Structura terțiară a mioglobinei. Luat și editat de la: Thomas Splettstoesser. Modificat de Alejandro Porto. [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)].
Reguli generale de pliere a proteinelor globulare
După cum sa menționat deja, proteinele prezintă forme particulare de pliere, care le conferă, de asemenea, caracteristici particulare. Această pliere nu este aleatorie și este favorizată atât de structura primară și secundară, cât și de unele interacțiuni non-covalente și există, de asemenea, unele restricții fizice la pliere, pentru care au fost formulate unele reguli:
- Toate proteinele globulare au modele de distribuție definite, cu grupările R hidrofobe îndreptate către interiorul moleculei și resturile hidrofile din stratul exterior. Acest lucru necesită cel puțin două straturi de structură secundară. Bucla β-α-β și vârful α-α pot furniza aceste două straturi.
- Foliile β sunt în general aranjate într-o formă laminată cu stânga..
- Într-un lanț polipeptidic, pot apărea diferite rotații care trec de la o structură secundară la alta, cum ar fi rotațiile β sau γ, care pot inversa direcția lanțului cu patru reziduuri de aminoacizi sau mai puțin..
- Proteinele globulare posedă helice α, foi β, rotații și segmente structurate neregulat.
Denaturarea proteinelor
Dacă o proteină își pierde structura tridimensională nativă (naturală), își pierde activitatea biologică și majoritatea proprietăților sale specifice. Acest proces este cunoscut sub denumirea de denaturare.
Denaturarea poate apărea atunci când condițiile naturale de mediu se schimbă, de exemplu prin variația temperaturii sau a pH-ului. Procesul este ireversibil în multe proteine; cu toate acestea, alții își pot recâștiga spontan structura naturală atunci când condițiile normale de mediu sunt restabilite..
Referințe
- C.K. Mathews, K.E. van Holde și K.G. Ahern (2002). Biochimie. Ediția a 3-a. Benjamin / Cummings Publishing Company, Inc.
- R. Murray, P. Mayes, D.C. Granner și V.W. Rodwell (1996). Biochimia lui Harper. Appleton & Lange.
- J.M. Berg, J.L. Tymoczko și L. Stryer (2002). Biochimie. Ediția a 5-a. W. H. Freeman and Company.
- W.M. Becker, L.J. Kleinsmith & J. Hardin (2006) Lumea celulei. Ediția a 6-a. Pearson Education Inc..
- A. Lehninger (1978). Biochimie. Ediciones Omega, S.A.
- T. McKee și J.R. McKee (2003). Biochimie: baza moleculară a vieții. Ediția a 3-a. Companiile McGraw-HiII, Inc.



Nimeni nu a comentat acest articol încă.