
Istoria, descrierea și concluziile experimentului Rutherford
Experimentul Rutherford, efectuat între 1908 și 1913, a constat în bombardarea unei folii subțiri de aur cu grosimea de 0,0004 mm cu particule alfa și analizarea modelului de dispersie pe care aceste particule l-au lăsat pe un ecran fluorescent.
De fapt, Rutherford a efectuat numeroase experimente, rafinând detaliile din ce în ce mai mult. După analizarea atentă a rezultatelor, au rezultat două concluzii foarte importante:
-Sarcina pozitivă a atomului este concentrată într-o regiune numită nucleu.
-Acest nucleu atomic este incredibil de mic în comparație cu dimensiunea atomului.
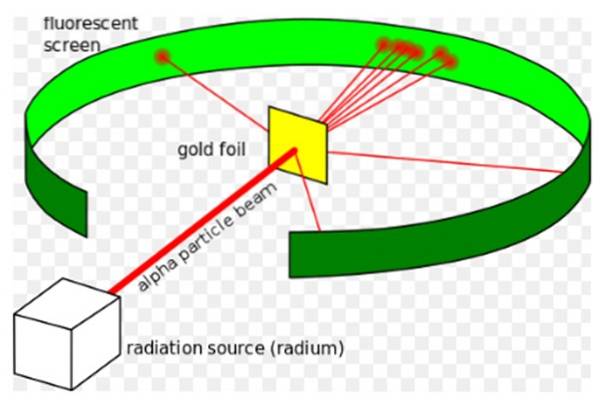
Ernest Rutherford (1871-1937) a fost un fizician născut în Noua Zeelandă al cărui domeniu de interes era radioactivitatea și natura materiei. Radioactivitatea a fost un fenomen recent când Rutherford și-a început experimentele, acesta fusese descoperit de Henri Becquerel în 1896.
În 1907 Rutherford a mers la Universitatea din Manchester din Anglia pentru a studia structura atomului, folosind aceste particule alfa ca sonde pentru a privi în interiorul unei structuri atât de mici. Fizicienii Hans Geiger și Ernest Marsden l-au însoțit în această sarcină..
Ei sperau să vadă cum o particulă alfa, care este un atom de heliu dublu ionizat, va interacționa cu un singur atom de aur, pentru a se asigura că orice abatere pe care a experimentat-o se datorează numai forței electrice..
Cu toate acestea, majoritatea particulelor alfa au trecut prin folia de aur doar cu o ușoară abatere..
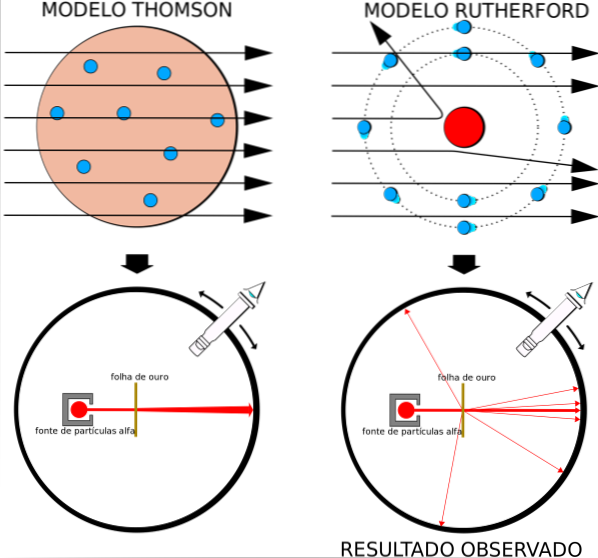
Acest fapt era în total acord cu modelul atomic al lui Thomson, cu toate acestea, spre surprinderea cercetătorilor, un procent mic din particulele alfa a cunoscut o abatere destul de remarcabilă..
Și un procent și mai mic de particule s-ar întoarce, revenind complet înapoi. De ce au fost aceste rezultate neașteptate?
Indice articol
- 1 Descrierea și concluziile experimentului
- 1.1 Concluzii
- 2 Influențe asupra modelului atomului
- 2.1 Dezavantaje ale modelului Rutherford
- 2.2 Protonul și neutronul
- 3 Cum este un model la scară al atomului de hidrogen?
- 4 Modelul atomic de astăzi
- 5 Referințe
Descrierea și concluziile experimentului
De fapt, particulele alfa pe care Rutherford le-a folosit ca sondă sunt nuclee de heliu și, în acel moment, se știa doar că aceste particule erau încărcate pozitiv. Astăzi se știe că particulele alfa sunt formate din doi protoni și doi neutroni..
Particulele alfa și particulele beta au fost identificate de Rutherford ca două tipuri diferite de radiații din uraniu. Particulele alfa, mult mai masive decât electronul, au o sarcină electrică pozitivă, în timp ce particulele beta pot fi electroni sau pozitroni..
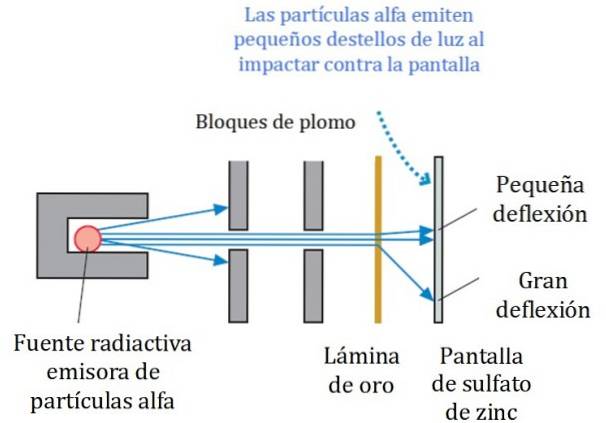
O schemă simplificată a experimentului este prezentată în Figura 2. Fasciculul de particule alfa provine dintr-o sursă radioactivă. Geiger și Marsden au folosit gazul radon ca emițător.
Blocurile de plumb au fost folosite pentru a direcționa radiația către folia de aur și pentru a preveni accesul direct la ecranul fluorescent. Plumbul este un material care absoarbe radiațiile.
Fascicul astfel direcționat a fost apoi făcut să lovească o folie subțire de aur și majoritatea particulelor și-au continuat drumul către ecranul fluorescent cu sulfat de zinc, unde au lăsat o mică urmă de lumină. Geiger a fost însărcinat să le numere unul câte unul, deși ulterior au proiectat un dispozitiv care o făcea.
Faptul că unele particule au suferit o mică deviere nu i-a surprins pe Rutherford, Geiger și Marsden. La urma urmei, există sarcini pozitive și negative asupra atomului care exercită forțe asupra particulelor alfa, dar din moment ce atomul este neutru, ceea ce știau deja, abaterile trebuiau să fie mici..
Surpriza experimentului este că câteva particule pozitive au fost săltate aproape direct înapoi..
Concluzii
Aproximativ 1 din 8000 de particule alfa au fost deviate la unghiuri mai mari de 90 °. Puțini, dar suficient pentru a pune la îndoială unele lucruri.
Modelul atomic la modă a fost cel al budincii de stafide de Thomson, fostul profesor al lui Rutherford la Laboratorul Cavendish, dar Rutherford s-a întrebat dacă ideea unui atom fără nucleu și cu electroni încorporați ca stafide este corectă..
Pentru că se dovedește că aceste devieri mari ale particulelor alfa și faptul că câteva sunt capabile să se întoarcă, pot fi explicate numai dacă un atom are un nucleu mic, greu și pozitiv. Rutherford a presupus că doar forțele electrice de atracție și respingere, așa cum este indicat de legea lui Coulomb, sunt responsabile pentru orice abatere..
Când unele dintre particulele alfa se apropie direct spre acest nucleu și din moment ce forța electrică variază în funcție de pătratul invers al distanței, ele simt o respingere care le determină împrăștierea cu unghi larg sau devierea înapoi..
Cu siguranță, Geiger și Marsden au experimentat bombardând foi de metale diferite, nu doar aur, deși acest metal a fost cel mai potrivit pentru maleabilitatea sa, pentru a crea foi foarte subțiri..
Prin obținerea unor rezultate similare, Rutherford a fost convins că sarcina pozitivă din atom ar trebui să fie localizată în nucleu și nu dispersată în volumul său, așa cum a postulat Thomson în modelul său..
Pe de altă parte, deoarece marea majoritate a particulelor alfa au trecut fără devieri, nucleul trebuia să fie foarte, foarte mic în comparație cu dimensiunea atomică. Cu toate acestea, acest nucleu a trebuit să concentreze cea mai mare parte a masei atomului.
Influențe asupra modelului atomului
Rezultatele l-au surprins foarte mult pe Rutherford, care a declarat la o conferință la Cambridge: „... Este ca atunci când trageți o ghiulea de 15 inci pe o foaie de hârtie de țesut și proiectilul sare direct la voi și vă lovește.".
Deoarece aceste rezultate nu au putut fi explicate prin modelul atomic al lui Thomson, Rutherford a propus că atomul era format dintr-un nucleu, foarte mic, foarte masiv și încărcat pozitiv. Electronii au rămas pe orbite în jurul lui, ca un sistem solar în miniatură.
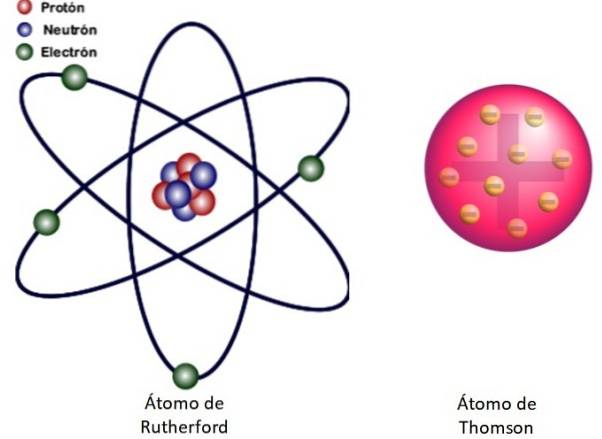
Acesta este modelul nuclear al atomului prezentat în Figura 3 din stânga. Deoarece și electronii sunt foarte, foarte mici, se dovedește că atomul este aproape totul ... gol! Prin urmare, majoritatea particulelor alfa trec prin foaia abia deviată..
Iar analogia cu un sistem solar în miniatură este foarte precisă. Nucleul atomic joacă rolul Soarelui, conținând aproape toată masa plus sarcina pozitivă. Electronii orbitează în jurul lor ca planete și poartă o sarcină negativă. Ansamblul este neutru electric.
Despre distribuția electronilor în atom, experimentul lui Rutherford nu a arătat nimic. S-ar putea crede că particulele alfa ar avea o anumită interacțiune cu ele, dar masa electronilor este prea mică și nu au putut să devieze în mod semnificativ particulele..
Dezavantaje ale modelului Rutherford
O problemă cu acest model atomic a fost tocmai comportamentul electronilor.
Dacă acestea nu ar fi statice, ci orbitează nucleul atomic în orbite circulare sau eliptice, direcționate prin atracție electrică, acestea ar ajunge să cadă spre nucleu..
Acest lucru se datorează faptului că electronii accelerați pierd energie și, dacă se întâmplă acest lucru, ar fi prăbușirea atomului și a materiei..
Din fericire nu asta se întâmplă. Există un fel de stabilitate dinamică care previne colapsul. Următorul model atomic, după cel al lui Rutherford, a fost al lui Bohr, care a dat câteva răspunsuri cu privire la motivul pentru care nu se produce colapsul atomic.
Protonul și neutronul
Rutherford a continuat să facă experimente de împrăștiere. Între 1917 și 1918, el și asistentul său William Kay au ales să bombardeze atomii de azot gazos cu particulele alfa extrem de energice din bismut-214..
A fost din nou surprins, când a detectat nuclei de hidrogen. Aceasta este ecuația reacției, prima transmutație nucleară artificială realizată vreodată:
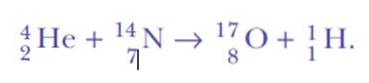
Răspunsul a fost: din același azot. Rutherford atribuise hidrogenului numărul atomic 1, deoarece este cel mai simplu element dintre toate: un nucleu pozitiv și un electron negativ.
Rutherford găsise o particulă fundamentală pe care el o numea proton, un nume derivat din cuvântul grecesc pentru Primul. În acest fel, protonul este un component esențial al fiecărui nucleu atomic..
Mai târziu, în jurul anului 1920, Rutherford a propus că trebuie să existe o particulă neutră cu o masă foarte asemănătoare cu cea a protonului. El a numit această particulă neutron și face parte din aproape toți atomii cunoscuți. Fizicianul James Chadwick a identificat-o în cele din urmă în 1932.
Cum este un model la scară al atomului de hidrogen?
Atomul de hidrogen este, după cum am spus, cel mai simplu dintre toate. Cu toate acestea, nu a fost ușor să dezvoltăm un model pentru acest atom..
Descoperirile succesive au dat naștere Fizicii Cuantice și o întreagă teorie care descrie fenomene la scară atomică. În timpul acestui proces, a evoluat și modelul atomic. Dar să aruncăm o privire la întrebarea dimensiunilor:
Atomul de hidrogen are un nucleu format dintr-un proton (pozitiv) și are un singur electron (negativ).
Raza atomului de hidrogen a fost estimată la 2,1 x 10-10 m, în timp ce cel al protonului este de 0,85 x 10 -cincisprezece m sau 0,85 femometre. Numele acestei mici unități se datorează lui Enrico Fermi și este folosit foarte mult atunci când lucrează la această scară.
Ei bine, coeficientul dintre raza atomului și cea a nucleului este de ordinul 105 m, adică atomul este de 100.000 de ori mai mare decât nucleul!!.
Cu toate acestea, trebuie luat în considerare faptul că în modelul contemporan, bazat pe mecanica cuantică, electronul învelește nucleul într-un fel de nor numit orbital (un orbital nu este o orbită) și electronul, la scara atomică, nu este punctual.
Dacă atomul de hidrogen ar fi mărit - cu imaginație - la dimensiunea unui teren de fotbal, atunci nucleul compus dintr-un proton pozitiv ar avea dimensiunea unei furnici din centrul câmpului, în timp ce electronul negativ ar fi ca un fel de fantomă , împrăștiat pe tot câmpul și înconjurând nucleul pozitiv.
Modelul atomic de astăzi
Acest model atomic de „tip planetar” este foarte înrădăcinat și este imaginea pe care majoritatea oamenilor o au despre atom, deoarece este foarte ușor de vizualizat. in orice caz, Nu este modelul acceptat astăzi în domeniul științific.
Modelele atomice contemporane se bazează pe mecanica cuantică. Ea subliniază că electronul din atom nu este un punct încărcat negativ care urmează orbite precise, precum cele imaginate de Rutherford..
Mai degrabă, electronul este risipit în zone, în jurul nucleului pozitiv, numit orbitali atomici. De la el putem ști probabilitate a fi într-un stat sau altul.
În ciuda acestui fapt, modelul lui Rutherford a reprezentat un progres enorm în înțelegerea structurii interioare a atomului. Și a pregătit calea pentru ca mai mulți cercetători să o perfecționeze în continuare..
Referințe
- Andriessen, M. 2001. Curs HSC. Fizică 2. Jacaranda HSC Science.
- Arfken, G. 1984. Fizică universitară. Academic Press.
- Knight, R. 2017. Fizica pentru oamenii de știință și inginerie: o abordare strategică. Pearson.
- Fizică OpenLab. Experimentul Rutherford-Geiger-Marsden. Recuperat de pe: physicsopenlab.org.
- Rex, A. 2011. Fundamentele fizicii. Pearson.
- Tyson, T. 2013. Experimentul Rutherford Scattering. Adus de la: 122.physics.ucdavis.edu.
- Xaktly. Experimentele lui Rutherford. Recuperat de pe: xaktly.com.
- Wikipedia. Experimentul lui Rutherford. Recuperat de pe: es.wikipedia.org.



Nimeni nu a comentat acest articol încă.