
Proprietăți, riscuri și utilizări ale ferocianurii de potasiu
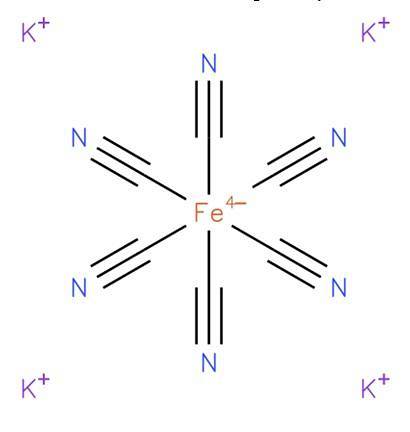
ferocianură de potasiu, cunoscut și sub numele de hexacianoferat de potasiu (II) sau galben prusian, este un compus anorganic cu formula K4[Faith (CN)6]. Este o sare de potasiu a complexului de coordonare a ferocianurii (Fe (CN)64-) și este în general sub forma trihidrat K4[Faith (CN)6] · HDouăO. Structura sa este prezentată în figura 1 (EMBL-EBI, 2008).
Din punct de vedere istoric, a fost fabricat din surse de dioxid de carbon cu surse organice, depuneri de fier și carbonat de potasiu. Sursele obișnuite de azot și carbon au fost resturi de piele, măruntaie sau sânge uscat.
În prezent ferocianura de potasiu este produsă industrial din cianură de hidrogen, clorură de fier și hidroxid de calciu, a cărei combinație dă CaDouă [Faith (CN) 6] · 11HDouăSAU.
Această soluție este apoi tratată cu săruri de potasiu pentru a precipita sarea mixtă de calciu-potasiu CaK.Două [Faith (CN) 6], care la rândul său este tratat cu carbonat de potasiu pentru a da sarea tetrapotassium.
Indice articol
- 1 Proprietăți fizice și chimice
- 2 Reactivitate și pericole
- 2.1 Contactul cu ochii
- 2.2 Contactul cu pielea
- 2.3 Inhalare
- 2.4 Ingerare
- 3 utilizări
- 3.1 1- Industria alimentară
- 3.2 2- Industria minieră și metalurgică
- 3.3 3- Reactiv de laborator
- 4 Referințe
Proprietati fizice si chimice
Ferocianura de potasiu este un cristal monoclinic de culoare galben sau galben pal, în funcție de nivelul de hidratare, fără o aromă caracteristică (Centrul Național pentru Informații despre Biotehnologie., 2017). Aspectul său este prezentat în figura 2 (Ferocianură de potasiu, 2017).

Compusul are o greutate moleculară de 368,35 g / mol pentru forma anhidră și 422,388 g / mol pentru forma trihidrat. Are o densitate de 1,85 g / ml și un punct de topire de 70 ° C unde începe să se descompună (Royal Society of Chemistry, 2015).
Compusul este solubil în apă, fiind capabil să dizolve 28,9 grame de compus în 100 ml din acest solvent. Este insolubil în dietil eter, etanol și toluen. Compusul reacționează la căldură pentru a forma cianură de potasiu conform reacției:
K4[Faith (CN)6] → 4 KCN + FeCDouă + NDouă
În combinație cu acizi concentrați, formează cianură de hidrogen (HCN), care este un gaz foarte otrăvitor, inflamabil și poate forma amestecuri explozive în aer (Laffort, 2001).
Reactivitate și pericole
Ferocianura de potasiu este un compus stabil, incompatibil cu acizii puternici și agenții oxidanți. Ferocianura de potasiu nu este toxică și nu se descompune în cianură în organism. Toxicitatea la șobolani este scăzută, cu o doză letală (DL50) la 6400 mg / kg.
Substanța este toxică pentru plămâni și mucoase. Compusul poate provoca iritații în caz de contact cu pielea și ochii..
Atunci când este ingerat, poate provoca iritații ale tractului gastro-intestinal și, în caz de inhalare, provoacă iritarea mucoasei nazale și a sistemului respirator..
Contactul cu ochii poate duce la deteriorarea corneei sau la orbire. Contactul cu pielea poate provoca inflamații și vezicule.
Inhalarea prafului va produce iritarea tractului gastro-intestinal sau respirator, caracterizată prin arsură, strănut și tuse. Supraexpunerea severă poate provoca leziuni pulmonare, sufocare, inconștiență sau moarte..
Contact vizual
În cazul contactului cu ochii, lentilele de contact trebuie verificate și îndepărtate. Ochii trebuie spălați imediat cu multă apă rece timp de cel puțin 15 minute.
Contact cu pielea
Zona afectată trebuie clătită imediat cu multă apă timp de cel puțin 15 minute, îndepărtând îmbrăcămintea și încălțămintea contaminată. Acoperiți pielea iritată cu un emolient.
Spălați hainele și încălțămintea înainte de refolosire. Dacă contactul este sever, spălați cu un săpun dezinfectant și acoperiți pielea contaminată cu o cremă antibacteriană.
Inhalare
Victima trebuie mutată într-un loc răcoros. Dacă nu respiră, trebuie administrată respirație artificială. Dacă respirația este dificilă, dați oxigen.
Ingerare
Dacă compusul este ingerat, vărsăturile nu trebuie induse decât dacă sunt instruite de personalul medical. Slăbiți îmbrăcămintea strânsă, cum ar fi gulerul, cămașa sau cravata cămășii.
În toate cazurile, trebuie acordată imediat asistență medicală (Fișa tehnică de securitate a materialului Ferocianură de potasiu trihidrat, 2013).
Aplicații
1- Industria alimentară
Galbenul prusac este, de asemenea, cunoscut pentru numărul său aditiv alimentar european aprobat: E536 și are diverse utilizări în industria alimentară. Este utilizat ca agent antiaglomerant atât pentru sarea de drum, cât și pentru sarea de masă.
De asemenea, are o utilizare oenologică pentru îndepărtarea cuprului și fierului în vinificație. Cuprul este folosit ca fungicide în struguri (Universitatea Wageningen, 2014).
De asemenea, este utilizat pentru fermentarea acidului citric (D. S. Clark, 1965). Ferocianura de potasiu poate fi folosită și ca îngrășământ pentru plante.
2- Industria minieră și metalurgică
Ferocianura de potasiu este utilizată pentru îndepărtarea cuprului din mineralele din molibden. Este, de asemenea, utilizat pentru cimentarea oțelului (ferocianură de potasiu, K4Fe (CN) 6, 2012).
Cimentarea este un tratament termochimic aplicat pieselor din oțel. Procesul aduce carbonul la suprafață prin difuzie, care este impregnat prin modificarea compoziției sale.
3- Reactiv de laborator
Ferocianura de potasiu este utilizată pentru a determina concentrația de permanganat de potasiu, un compus adesea utilizat în titrări pe baza reacțiilor redox..
Ferocianura de potasiu este utilizată într-un amestec cu fericianură de potasiu și soluție tamponată cu fosfat pentru a furniza un tampon pentru beta-galactozidază, care este utilizat pentru scindarea X-Gal (5-brom-4-clor-3-indolil-β-D-galactopiranozidă, oferind o vizualizare albastru strălucitor în care un anticorp (sau altă moleculă), conjugat cu Beta-gal, s-a legat de ținta sa.
Compusul este, de asemenea, utilizat pentru producerea albastrului prusac. Când reacționează cu Fe (III) dă o culoare albastră prusiană, motiv pentru care este utilizat ca reactiv de identificare pentru fier în laboratoare..
Este, de asemenea, utilizat pentru determinarea zincului în probele de sulfură de zinc. Proba este dizolvată în HCI 6N și fierbeți sub capotă pentru a îndepărta hidrogenul sulfurat, neutralizați cu hidroxid de amoniu și adăugați 3 picături de HCI.
Se încălzește până fierbe și se adaugă 5 ml de soluție 1N de ferocianură de potasiu. Prezența unui precipitat de ferocianură de zinc alb indică un test pozitiv pentru acest element (Mehlig, 1927).
Referințe
- S. Clark, K. I. (1965). Efectul ferocianurii de potasiu asupra compoziției chimice a mustului de melasă utilizat în fermentarea acidului citric. Biotehnologie și bioinginerie Volumul 7, numărul 2, 269-278. Recuperat de la onlinelibrary.wiley.com.
- EMBL-EBI. (2008, 16 ianuarie). hexacianoferat de potasiu (4−). Recuperat de pe ebi.ac.uk.
- (2001, 5 martie). FERROCIANURA DE POTASIU. Recuperat de la laffort.com.
- Fișă tehnică de securitate a materialului Ferocianură de potasiu trihidrat. (2013, 21 mai). Recuperat de la sciencelab.com.
- Mehlig, J. P. (1927). Utilizarea ferocianurii de potasiu ca test de confirmare a zincului. Chem. Educ. 4 (6), 722. Recuperat de la pubs.acs.org.
- Centrul Național pentru Informații despre Biotehnologie ... (2017, 15 aprilie). Baza de date compusă PubChem; CID = 161067. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Ferocianură de potasiu. (2017, 25 martie). Recuperat de la sciencemadness.org.
- Ferocianură de potasiu, K4Fe (CN) 6. (2012). Recuperat de la atomistry.com.
- Societatea Regală de Chimie. (2015). ferocianură de potasiu. Recuperat de la chemspider.com.
- Universitatea Wageningen. (2014, 14 august). E536: Ferocianură de potasiu. Recuperat de pe food-info.net.



Nimeni nu a comentat acest articol încă.