
Istoricul fosforului, proprietăți, structură, obținere, utilizări
Meci Este un element nemetalic care este reprezentat de simbolul chimic P și are numărul atomic 15. Are trei forme alotropice principale: fosfor alb, roșu și negru. Fosforul alb este fosforescent, arde spontan când este expus la aer și este, de asemenea, foarte otrăvitor..
Fosforul alb la o temperatură de 250 ° C devine fosfor roșu; o formă insolubilă, polimerică, care nu arde în aer. La temperaturi și presiuni ridicate, precum și în prezența sau nu a catalizatorilor, se obține fosfor negru, care seamănă cu grafitul și este un bun conductor de electricitate..

Fosforul a fost izolat pentru prima dată de H. Brand în 1669. Pentru aceasta a folosit urina ca sursă a acestui element. În 1770, W. Scheele a descoperit că poate izola și fosforul din oase.
Mai târziu, datorită creării cuptorului electric de către J. Burgess Readman (1800), rocile fosfatice au devenit principala sursă de producere a fosforului din fluoroapatitul mineral, prezent în ele..
Fosforul este al doisprezecelea cel mai abundent element din scoarța terestră, reprezentând 0,1% din greutate. În plus, este al șaselea element din abundență în corpul uman; concentrat în principal în oase sub formă de hidroxilapatită.
Prin urmare, este un element esențial pentru ființele vii, devenind unul dintre cei trei nutrienți principali ai plantelor. Fosforul face parte din structura chimică a acizilor nucleici; de compuși de stocare a energiei (ATP), coenzime; și, în general, a compușilor metabolismului.
Indice articol
- 1 Istorie
- 1.1 - Descoperire
- 1.2 - Dezvoltarea industrială
- 2 Proprietăți fizice și chimice
- 2.1 Aspect
- 2.2 Greutatea atomică
- 2.3 Număr atomic (Z)
- 2.4 Punct de topire
- 2.5 Punctul de fierbere
- 2.6 Densitate (temperatura camerei)
- 2.7 Căldura de fuziune
- 2.8 Căldura de vaporizare
- 2.9 Capacitate termică molară
- 2.10 stări de oxidare
- 2.11 Electronegativitate
- 2.12 Energia de ionizare
- 2.13 Conductivitatea termică
- 2.14 Ordinea magnetică
- 2.15 Izotopi
- 2.16 Fosforescență
- 2.17 Modificări alotropice
- 2.18 Solubilitate
- 2.19 Reactivitate
- 3 Structură și configurație electronică
- 3.1 - Legături și unitate tetraedrică
- 3.2 - Alotropi
- 4 Unde se găsește și se obține
- 4.1 Apatit și fosforit
- 4.2 Reducerea electrotermică a fluoroapatitei
- 5 aliaje
- 5.1 Cupru
- 5.2 Bronz
- 5.3 Nichelat
- 6 Riscuri
- 7 utilizări
- 7.1 - Fosfor elementar
- 7.2 - Compuși
- 8 Referințe
Poveste
- Descoperire
În urină

Fosforul a fost izolat de Henning Brand în 1669, fiind primul om care a izolat un element. Brand a fost un alchimist german din Hamburg și a reușit să obțină un compus de fosfor din urină. Pentru a face acest lucru, a colectat urina din 50 de găleți și i-a permis să se descompună.
Brand a evaporat apoi urina și a obținut un reziduu negricios, pe care l-a păstrat câteva luni. La aceasta a adăugat nisip și l-a încălzit, reușind să elimine gazele și uleiurile. În cele din urmă, a obținut un solid alb care strălucea în întuneric cu o culoare verde, pe care a numit-o „foc rece”..
Termenul „fosfor”, întâmplător, provine din cuvântul grecesc „Phosphoros” care înseamnă purtător de lumină..
Brand nu și-a publicat rezultatele experimentale și le-a vândut diferiților alchimiști, inclusiv: Johann Kraft, Kunckel Lowenstern și Wilhelm Leibniz. Probabil, unii dintre ei au raportat munca lui Brand Academiei de Științe din Paris, răspândind astfel cercetările lor.
Cu toate acestea, Brand nu a izolat de fapt fosforul, ci fosfatul de amoniac sodic [Na (NH4) PO4]. În 1680, Robert Boyle a îmbunătățit procedura lui Brand, prin care a reușit să obțină o formă alotropă de fosfor (P4).
În oase
Johan Gottlieb Gahn și Carl Wihelm Scheele au stabilit în 1769 că un compus de fosfor, fosfatul de calciu, a fost găsit în oase. Oasele degresate au fost supuse unui proces de digestie cu acizi puternici, cum ar fi acidul sulfuric.
Apoi, produsul de digestie a fost încălzit în recipiente de oțel cu cărbune și cărbune, obținându-se astfel fosfor alb prin distilare în replici. Oasele au fost principala sursă de fosfor până în 1840, când au fost înlocuite în acest scop de guano..
În guano
Guano este un amestec de excremente de păsări și produse de descompunere a păsărilor. A fost folosit ca sursă de fosfor și îngrășăminte în secolul al XIX-lea.
- Dezvoltare industriala
Rocile fosfatice au ajuns să fie folosite în 1850 ca sursă de fosfor. Aceasta, împreună cu invenția cuptorului electric pentru calcinarea rocilor de către James Burgess Readman (1888), a făcut din rocile fosfatice principala materie primă pentru producerea fosforului și a îngrășămintelor..
În 1819, au fost înființate fabricile de chibrituri, începând dezvoltarea industrială a utilizării fosforului..
Proprietati fizice si chimice
Aspect
În funcție de forma alotropică, poate fi incolor, alb ceros, galben, stacojiu, roșu, violet sau negru.
Greutate atomica
30,973 u
Număr atomic (Z)
cincisprezece
Punct de topire
Fosfor alb: 44,15 ºC
Fosfor roșu: ~ 590 ºC
Punct de fierbere
Fosfor alb: 280,5 ºC
Densitate (temperatura camerei)
Alb: 1,823 g / cm3
Roșu: 2,2-2,34 g / cm3
Violet: 2,36 g / cm3
Negru: 2,69 g / cm3
Căldura de fuziune
Fosfor alb: 0,66 kJ / mol
Căldura de vaporizare
Fosfor alb: 51,9 kJ / mol
Capacitatea de căldură molară
Fosfor alb: 23,824 J / (mol.K)
Stări de oxidare
-3, -2, -1, +1, +2, +3, +4 și +5
În funcție de electronegativitatea elementelor cu care se combină, fosforul poate arăta starea de oxidare +3 sau -3. Fosforul, spre deosebire de azot, tinde să reacționeze preferențial cu starea de oxidare +5; acesta este cazul pentoxidului de fosfor (PDouăSAU5 sau PDouă5+SAU5Două+).
Electronegativitate
2.19 pe scara Pauling
Energie de ionizare
-Prima: 1.101 kJ / mol
-În al doilea rând: 2.190,7 kJ / mol
-În al treilea rând: 2.914 kJ / mol
Conductivitate termică
Fosfor alb: 0,236 W / (mK)
Fosfor negru: 12,1 W / (mK)
Arată modul în care fosforul negru conduce de aproape șase ori mai multă căldură decât fosforul alb.
Ordinea magnetică
Fosforii albi, roșii, mov și negri sunt diamagnetici.
Izotopi
Fosforul are 20 de izotopi, principalii fiind: 31P, singurul izotop stabil cu o abundență de 100%; 32P, izotop care emite β- și cu un timp de înjumătățire de 14,28 zile; Da 33P, un izotop care emite β- și cu un timp de înjumătățire de 25,3 zile.
Fosforescenţă
Fosforul alb este fosforescent și emite o lumină verde în întuneric.
Modificări alotropice
Fosforul alb este instabil și se schimbă la temperaturi apropiate de 250 ° C într-o formă polimerică cunoscută sub numele de fosfor roșu, care poate varia de la culoare portocaliu la violet. Este o substanță amorfă, dar poate deveni cristalină; nu strălucește în întuneric sau nu arde în aer.
Fosforul alb la temperaturi și presiuni ridicate, sau în prezența catalizatorilor, se transformă într-o altă formă polimerică decât fosforul roșu: fosforul negru. Aceasta este o substanță cristalină de culoare neagră, inertă, similară cu grafitul și care are capacitatea de a conduce electricitatea.
Solubilitate
Fosforul alb sub formă pură este insolubil în apă, deși poate fi solubilizat în sulfură de carbon. Între timp, fosforii roșii și negri sunt insolubili în apă și sunt mai puțin volatili decât fosforul alb..
Reactivitate
Fosforul arde spontan în aer pentru a forma PDouăSAU5, iar acesta la rândul său poate reacționa cu trei molecule de apă pentru a forma acid ortofosforic sau fosforic (H3PO4).
Prin acțiunea apei calde, fosfina (PH3) și oxacizi de fosfor.
Acidul fosforic acționează asupra rocilor fosfatice, provocând fosfat dihidrogen calcic sau superfosfat [Ca (HDouăPO4)Două].
Poate reacționa cu halogeni pentru a forma halogenuri PX3, X reprezentând F, Cl, Br sau I; sau halogenuri cu formula PX5, unde X este F, Cl sau Br.
De asemenea, fosforul reacționează cu metale și metaloizi pentru a forma fosfuri și cu sulf pentru a forma diverse sulfuri. Pe de altă parte, se leagă de oxigen pentru a crea esteri. În același mod, se combină cu carbonul pentru a forma compuși organici fosforici..
Structura și configurația electronică
- Legături și unitate tetraedrică
Atomii de fosfor au următoarea configurație electronică:
[Ne] 3sDouă 3p3
Prin urmare, are cinci electroni de valență, cum ar fi azotul și celelalte elemente din grupa 15. Deoarece este un element nemetalic, atomii săi trebuie să formeze legături covalente până când octetul de valență este complet. Azotul realizează acest lucru stabilindu-se ca molecule diatomice NDouă, cu o legătură triplă, N≡N.
La fel se întâmplă și cu fosforul: doi dintre atomii săi de P se leagă cu o legătură triplă pentru a forma molecula de P.Două, P≡P; adică alotropul difosforos. Cu toate acestea, fosforul are o masă atomică mai mare decât azotul, iar orbitalii săi de 3p, mai difuzi decât 2p de azot, se suprapun mai puțin eficient; prin urmare, PDouă există doar în stare gazoasă.
În schimb, la temperatura camerei atomii P preferă să se organizeze covalent într-un alt mod: într-o moleculă tetraedrică P4:

Rețineți că în imaginea superioară toți atomii P au trei legături simple în loc de o legătură triplă. Astfel, fosforul din P4 își completează octetul de valență. Cu toate acestea, în P4 există tensiune în legăturile P-P, deoarece unghiurile lor sunt departe de 109,5º la ochiul liber.
- Alotropii
Fosfor alb
Aceeași imagine a unităților P.4 și instabilitatea sa explică de ce fosforul alb este cel mai instabil alotrop al acestui element.
Unități P4 sunt dispuse în spațiu pentru a defini un cristal bcc (faza α) în condiții normale. Când temperatura scade la -77,95 ° C, cristalul bcc se transformă într-un hcp mai dens (probabil) (faza β). Adică unitățile P4 sunt dispuse în două straturi alternante, A și B, pentru a stabili o secvență ABAB ...
Fosfor roșu
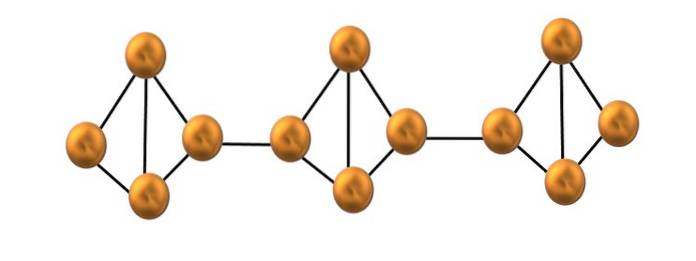
Numai un segment mic al structurii de fosfor roșu este prezentat în imaginea superioară. Deoarece cele trei unități sunt aliniate „simetric”, se poate spune că este o structură cristalină, care se obține prin încălzirea acestui fosfor la peste 250 ° C..
Cu toate acestea, fosforul roșu constă, de cele mai multe ori, dintr-un solid amorf, deci structura sa este dezordonată. Apoi, lanțurile polimerice ale lui P4 ar fi aranjate fără un model aparent, unele deasupra și altele sub același plan în mod arbitrar.
Rețineți că aceasta este principala diferență structurală dintre fosforul alb și roșu: în primul, P4 sunt individuale, iar în al doilea formează lanțuri. Acest lucru este posibil, deoarece una dintre legăturile P-P din tetraedru este ruptă pentru a se lega de tetraedrul vecin. Astfel, tensiunea inelară este redusă, iar fosforul roșu câștigă o stabilitate mai mare..
Când există un amestec de ambii alotropi, acesta este oferit ochiului sub formă de fosfor galben; un amestec de tetraedre și lanțuri de fosfor amorf. De fapt, fosforul alb devine gălbui atunci când este expus razelor solare, deoarece radiația favorizează ruperea legăturii P-P deja menționate..
Fosfor violet sau Hittorf
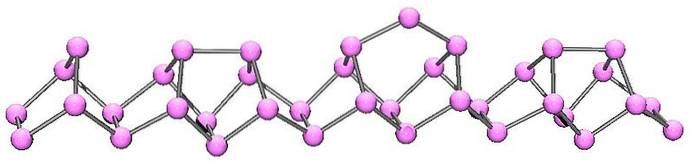
Fosforul violet este evoluția finală a fosforului roșu. După cum se poate vedea în imaginea de mai sus, acesta constă încă dintr-un lanț polimeric; dar acum structurile sunt mai complicate. Se pare că unitatea structurală nu mai este P4 dar PDouă, dispuse în așa fel încât să formeze inele pentagonale neregulate.
În ciuda aspectului asimetric al structurii, aceste lanțuri polimerice reușesc să se aranjeze suficient de bine și cu periodicitate pentru ca fosforul violet să stabilească cristale monoclinice..
Fosfor negru
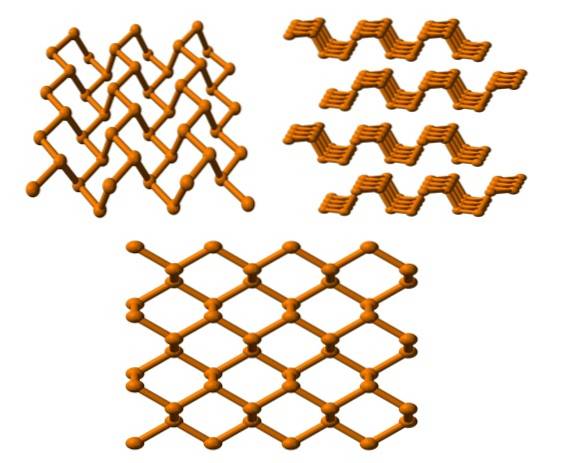
Și în sfârșit avem cel mai stabil alotrop fosforos: cel negru. Se prepară prin încălzirea fosforului alb sub o presiune de 12.000 atm.
În imaginea superioară (de mai jos), se poate vedea că structura sa, dintr-un plan superior, are o anumită asemănare cu cea a grafitului; este o rețea abruptă de inele hexagonale (chiar dacă arată ca niște pătrate).
În colțul din stânga sus al imaginii, ceea ce tocmai a fost comentat poate fi apreciat mai bine. Imprejurimile moleculare ale atomilor P sunt piramide trigonale. Rețineți că structura vizualizată din lateral (colțul din dreapta sus), este aranjată în straturi care se potrivesc una peste alta.
Structura fosforului negru este destul de simetrică și ordonată, ceea ce este în concordanță cu capacitatea sa de a se stabili ca cristale ortorombice. Stivuirea straturilor lor polimerice face atomii P indisponibili pentru multe reacții chimice; și de aceea este considerabil stabil și nu prea reactiv.
Deși merită menționat, forțele de dispersie din Londra și masele molare ale acestor solide fosforice sunt cele care guvernează unele dintre proprietățile lor fizice; în timp ce structurile și legăturile lor P-P definesc proprietățile chimice și alte proprietăți.
Unde se găsește și se obține
Apatit și fosforit
Este al doisprezecelea element al scoarței terestre și reprezintă 0,1% din greutate. Există aproximativ 550 de minerale care conțin fosfor, apatitul fiind cel mai important mineral pentru obținerea fosforului..
Apatitul este un mineral de fosfor și calciu care poate conține cantități variabile de fluor, clorură și hidroxid, a căror formulă este următoarea: [Ca10(PO4)6(F, Cl sau OH)Două)]. Pe lângă apatită, există și alte minerale fosforice de importanță comercială; așa este cazul wavelita și vivianita.
Roca fosfat sau fosforitul este principala sursă de fosfor. Este o rocă sedimentară nedritică care are un conținut de fosfor de 15-20%. Fosforul este de obicei prezent ca Ca10(PO4)6FDouă (fluoroapatită). Este prezent și sub formă de hidroxiapatită, deși într-o măsură mai mică.
În plus, fluoroapatita poate fi găsită ca parte a rocilor magmatice și metamorfice, precum și a calcarului și a șisturilor..
Reducerea electrotermică a fluoroapatitei
Rocile fosfat selectate sunt transferate la stația de tratare pentru procesare. Inițial, acestea sunt zdrobite pentru a obține fragmente stâncoase care sunt apoi măcinate în mori cu bile la 70 de rotații pe minut.
Apoi, produsul măcinării fragmentelor de rocă este cernut pentru a le putea fracționa. Acele fracțiuni cu un conținut de fosfor de 34% sunt alese ca pentoxid de fosfor (PDouăSAU5).
Fosfor alb (P4) se obține industrial prin reducerea electrotermică a fluoroapatitei cu carbon la o temperatură de 1.500 ºC în prezența oxidului de siliciu:
2Ca3(PO4)Două(s) + 6SiODouă(s) + 10 C (s) => P4(g) + CaSiO3(l) + CO (g)
P4 în stare gazoasă, după condensare, este colectat și depozitat ca un solid alb scufundat în apă pentru a preveni reacția cu aerul exterior.
Aliaje
Cupru
Pătura cu fosfor este fabricată cu procente diferite de cupru și fosfor: Cu 94% - P 6%; Cu 92% - P 8%; Cu 85% - P 15% etc. Aliajul este utilizat ca deoxidant, agent de umectare pentru industria cuprului și, de asemenea, ca nucleant în industria aluminiului..
Broncíneas
Sunt aliaje de cupru, fosfor și staniu care conțin 0,5 - 11% fosfor și 0,01 - 0,35% staniu. Staniul crește rezistența la coroziune, în timp ce fosforul crește rezistența la uzură a aliajului și îi conferă rigiditate.
Se folosește la fabricarea arcurilor, șuruburilor și, în general, la articolele care necesită rezistență la oboseală, uzură și coroziune chimică. Utilizarea acestuia este recomandată în elicele bărcilor.
Placat cu nichel
Cel mai cunoscut aliaj este NiPdouăzeci, folosind nichel fosforic în aliaje de lipire pentru a-și îmbunătăți rezistența la eroziune chimică, oxidare și temperaturi ridicate.
Aliajul este utilizat în componentele turbinei cu gaz și ale motoarelor cu reacție, galvanizării și în producția de electrozi de sudură.
Riscuri
Fosforul alb provoacă arsuri severe ale pielii și este o otravă puternică care poate fi fatală la o doză de 50 mg. Fosforul inhibă oxidarea celulară, interferând cu gestionarea oxigenului celular, care poate duce la degenerescența grasă și moartea celulară.
Intoxicația acută cu fosfor produce în primele patru zile de la ingestie dureri abdominale, arsuri, respirație cu miros de usturoi, vărsături fosforescente, transpirații, crampe musculare și chiar o stare de șoc..
Mai târziu, icter, petechii, hemoragie, afectare miocardică cu aritmii, alterarea sistemului nervos central și deces în a zecea zi după ingestie..
Cea mai evidentă manifestare a otrăvirii cronice cu fosfor este afectarea structurii osoase a maxilarului.
O creștere a concentrației plasmatice de fosfor (hiperfosfatemie), apare de obicei la pacienții cu insuficiență renală. Acest lucru determină un depozit anormal de fosfați în țesuturile moi, care poate duce la disfuncții vasculare și boli cardiovasculare..
Aplicații
Fosforul este un element esențial pentru plante și animale. Este unul dintre cei trei nutrienți principali ai plantelor, fiind necesar pentru creșterea și cerințele lor energetice. În plus, face parte din acizi nucleici, fosfolipide, produse intermediare ale proceselor metabolice etc..
La vertebrate, fosforul este prezent în oase și dinți sub formă de hidroxilapatită..
- Fosfor elementar

Cu fosfor, se face un smalț chimic care este utilizat pentru iluminarea semnelor plasate pe aluminiu și aliajele sale; precum și cupru fosfor și bronz.
De asemenea, este folosit pentru a produce bombe incendiare, grenade, bombe de fum și gloanțe de urmărire. Fosforul roșu este utilizat pentru a face chibrituri sau chibrituri de siguranță.
Fosforul alb este folosit pentru a produce organofosfați. În plus, este utilizat în producția de acid fosforic.
O cantitate mare de fosfor produs este incinerată pentru producerea de tetraoxid de fosfor (P4SAU10), obținut sub formă de pulbere sau solid.
- Compuși
Fosfină
Este materia primă pentru producerea diferiților compuși ai fosforului. Acționează ca un agent dopant pentru componentele electronice.
Acid fosforic
Este utilizat în producția de băuturi răcoritoare datorită aromei caracteristice pe care le conferă acestora. Acționează asupra rocilor fosfatice pentru a forma fosfat dihidrogen calcic [Ca (HDouăPO4)Două], cunoscut și sub numele de superfosfat, care este folosit ca îngrășământ.
Acidul fosforic este un element condiționant al smalțului dinților pentru a facilita aderența materialelor de restaurare. Se mai folosește, amestecat cu ulei, uree, gudron, bitum și nisip, pentru a forma asfalt; material utilizat la repararea căilor de comunicații terestre.
Organofosfați
Compușii organofosfați au numeroase aplicații; precum: ignifugi, pesticide, agenți de extracție, agenți cu acțiune nervoasă și pentru tratarea apei.
Dihidrogen Fosfat de calciu Dihidrat
Se folosește ca îngrășământ, praf de copt, aditiv pentru hrana animalelor și la fabricarea pastelor de dinți.
Pentoxid de fosfor
Este utilizat în analiza chimică ca agent de deshidratare și în sinteza organică ca agent de condensare. Compusul este destinat în principal producției de acid ortofosforic.
Tripolifosfat de sodiu
Utilizat în detergenți și ca dedurizator de apă, care îmbunătățește acțiunea detergenților și ajută la prevenirea coroziunii conductelor.
Fosfat trisodic
Folosit ca agent de curățare și dedurizator de apă.
Fosfați de sodiu
Fosfat de sodiu dibasic (NaDouăHPO4) și fosfat de sodiu monobazic (NaHDouăPO4) sunt componentele unui sistem tampon de pH, care acționează chiar și asupra ființelor vii; inclusiv ființele umane.
Referințe
- Reid Danielle. (2019). Alotropii de fosfor: forme, utilizări și exemple. Studiu. Recuperat de la: study.com
- Prof. Robert J. Lancashire. (2014). Lectura 5c. Structura elementelor, continuare P, S și I. Recuperat de la: chem.uwimona.edu.jm
- BYJU'S. (2019). Fosfor roșu. Recuperat de pe: byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang și colab. (2019). Proprietățile electronice structurale și optice ale fosforului albastru multistrat: un studiu de prim-principiu. Jurnalul nanomaterialelor, vol. 2019, ID articol 4020762, 8 pagini. doi.org/10.1155/2019/4020762
- Dr. Dough Stewar. (2019). Fapte despre elementele de fosfor. Chemicool. Recuperat de pe: chemicool.com
- Wikipedia. (2019). Fosfor. Recuperat de pe: en.wikipedia.org
- Helmenstine, Anne Marie, dr. (03 iulie 2019). Fapte despre fosfor (numărul atomic 15 sau simbolul elementului P). Recuperat de pe: thoughtco.com
- Institutul Linus Pauling. (2019). Fosfor. Recuperat de la: lpi.oregonstate.edu
- Bernardo Fajardo P. și Héctor Lozano V. (s.f.). Prelucrarea națională a rocilor de fosfat pentru producerea superfosfatului. [PDF]. Recuperat de pe: bdigital.unal.edu.co
- Editorii Enciclopediei Britanice. (16 noiembrie 2018). Element chimic fosfor. Encyclopædia Britannica. Recuperat de pe: britannica.com
- Reade International Corp. (2018). Aliaj de fosfor de cupru (CuP). Recuperat de pe: reade.com
- KBM Affilips. (27 decembrie 2018). Aliaj principal pentru nichel-fosfor (NiP). AZoM. Recuperat de pe: azom.com
- Lenntech B.V. (2019). Tabel periodic: fosfor. Recuperat de pe: lenntech.com
- Abhijit Naik. (2018, 21 februarie). Folosirea fosforului. Recuperat de pe: sciencestruck.com



Nimeni nu a comentat acest articol încă.