
Londra forțează caracteristici și exemple
Forțele din Londra, Forțele de împrăștiere de la Londra sau interacțiunile dipol-dipol induse sunt cel mai slab tip de interacțiuni intermoleculare. Numele său se datorează contribuțiilor fizicianului Fritz London și studiilor sale în domeniul fizicii cuantice.
Forțele Londrei explică modul în care moleculele interacționează ale căror structuri și atomi îi fac imposibilă formarea unui dipol permanent; adică se aplică fundamental moleculelor apolare sau atomilor izolați de gaze nobile. Spre deosebire de celelalte forțe ale lui Van der Waals, aceasta necesită distanțe extrem de scurte.

O bună analogie fizică a forțelor londoneze poate fi găsită în funcționarea sistemului de închidere cu velcro (imaginea de mai sus). Prin apăsarea unei părți a țesăturii brodate cu cârlige, iar cealaltă cu fibre, se creează o forță atractivă proporțională cu aria țesăturilor.
Odată ce ambele fețe sunt sigilate, trebuie exercitată o forță pentru a contracara interacțiunile lor (efectuate de degetele noastre) pentru a le separa. Același lucru este valabil și pentru molecule: cu cât sunt mai voluminoase sau mai plate, cu atât sunt mai mari interacțiunile lor intermoleculare la distanțe foarte mici..
Cu toate acestea, nu este întotdeauna posibilă abordarea acestor molecule la o distanță suficient de apropiată pentru ca interacțiunile lor să fie apreciabile..
Atunci când este cazul, necesită temperaturi foarte scăzute sau presiuni foarte mari; ca atare este cazul gazelor. De asemenea, aceste tipuri de interacțiuni pot fi prezente în substanțe lichide (cum ar fi n-hexan) și substanțe solide (cum ar fi iod)..
Indice articol
- 1 Caracteristici
- 1.1 Distribuția omogenă a sarcinii
- 1.2 Polarizabilitatea
- 1.3 Este invers proporțională cu distanța
- 1.4 Este direct proporțională cu masa moleculară
- 2 Exemple de forțe londoneze
- 2.1 În natură
- 2.2 Alcani
- 2.3 Halogeni și gaze
- 3 Referințe
Caracteristici
Ce caracteristici trebuie să aibă o moleculă pentru a interacționa folosind forțele londoneze? Răspunsul este că oricine ar putea să o facă, dar atunci când există un moment dipol permanent, interacțiunile dipol-dipol predomină mai mult decât cele împrăștiate, contribuind foarte puțin la natura fizică a substanțelor..
În structurile în care nu există atomi extrem de electronegativi sau a căror distribuție a sarcinii electrostatice este omogenă, nu există nicio extremă sau regiune care să fie considerată bogată (δ-) sau săracă (δ +) în electroni.
În aceste cazuri, trebuie să intervină alte tipuri de forțe sau în caz contrar acești compuși ar putea exista doar în faza gazoasă, indiferent de condițiile de presiune sau temperatură care operează pe ele..
Distribuția omogenă a sarcinii
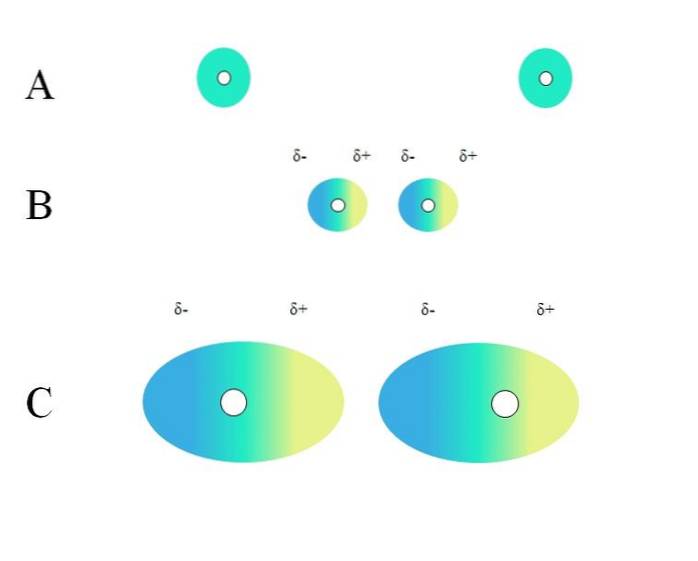
Doi atomi izolați, cum ar fi neonul sau argonul, au o distribuție omogenă a sarcinii. Acest lucru poate fi văzut în A, imaginea de sus. Cercurile albe din centru reprezintă nucleele, pentru atomi, sau scheletul molecular, pentru molecule. Această distribuție a încărcăturii poate fi considerată ca un nor verde de electroni.
De ce gazele nobile respectă această omogenitate? Deoarece au carcasa electronică complet plină, deci electronii lor ar trebui să simtă teoretic sarcina atractivă a nucleului în mod egal pe toți orbitalii..
Pe de altă parte, pentru alte gaze, cum ar fi oxigenul atomic (O), învelișul său este incomplet (ceea ce se observă în configurația sa electronică) și îl obligă să formeze molecula diatomică ODouă pentru a suplini această deficiență.
Cercurile verzi din A pot fi, de asemenea, molecule, mici sau mari. Norul său de electroni orbitează în jurul tuturor atomilor care îl compun, în special a celor mai electronegativi. În jurul acestor atomi norul va fi concentrat și va fi mai negativ, în timp ce alți atomi vor avea o deficiență electronică.
Cu toate acestea, acest nor nu este static, ci dinamic, așa că la un moment dat se vor forma scurte regiuni δ- și, + și un fenomen numit Polarizare.
Polarizabilitatea
În A norul verde indică o distribuție omogenă a sarcinii negative. Cu toate acestea, forța de atracție pozitivă exercitată de nucleu poate oscila asupra electronilor. Acest lucru provoacă o deformare a norului, creând astfel regiuni δ-, în albastru și δ +, în galben..
Acest moment dipol brusc din atom sau moleculă poate distorsiona un nor de electroni adiacent; cu alte cuvinte, induce un dipol brusc asupra vecinului său (B, imaginea de sus).
Acest lucru se datorează faptului că regiunea δ- deranjează norul vecin, electronii săi simt repulsie electrostatică și sunt orientați către polul opus, apărând δ+.
Rețineți cum se aliniază polii pozitivi cu polii negativi, la fel ca moleculele cu momente dipolare permanente. Cu cât norul de electroni este mai voluminos, cu atât nucleul îl va menține omogen în spațiu; și, de asemenea, cu cât deformarea acestuia este mai mare, așa cum se poate vedea în C.
Prin urmare, atomii și moleculele mici sunt mai puțin susceptibile de a fi polarizate de orice particulă din mediul lor. Un exemplu pentru această situație este ilustrat de molecula mică de hidrogen, HDouă.
Pentru ca acesta să se condenseze, sau chiar mai mult, să se cristalizeze, are nevoie de presiuni exorbitante pentru a-și forța moleculele să interacționeze fizic.
Este invers proporțional cu distanța
Deși se formează dipoli instantanee care îi induc pe alții în jurul lor, nu sunt suficienți pentru a menține atomii sau moleculele împreună..
În B există o distanță d care separă cei doi nori și cei doi nuclei ai acestora. Astfel încât ambii dipoli să poată rămâne un timp considerat, această distanță d trebuie să fie foarte mic.
Această condiție, o caracteristică esențială a forțelor londoneze (amintiți-vă de închiderea Velcro), trebuie îndeplinită pentru a avea un efect vizibil asupra proprietăților fizice ale materiei..
O data d este mic, nucleul din stânga din B va începe să atragă regiunea albastră δ- a atomului sau moleculei vecine. Acest lucru va deforma și mai mult norul, așa cum se vede în C (miezul nu mai este în centru, ci în dreapta). Apoi, vine un punct în care ambii nori ating și „sar”, dar suficient de încet pentru a-i menține un timp..
Prin urmare, forțele londoneze sunt invers proporționale cu distanța d. De fapt, factorul este egal cu d7, deci o ușoară variație a distanței dintre cei doi atomi sau molecule va slăbi sau întări împrăștierea Londrei.
Este direct proporțională cu masa moleculară
Cum se mărește dimensiunea norilor astfel încât să se polarizeze mai ușor? Adăugarea de electroni și pentru aceasta nucleul trebuie să aibă mai mulți protoni și neutroni, crescând astfel masa atomică; sau, adăugând atomi la coloana vertebrală a moleculei, care la rândul său ar crește masa sa moleculară
În acest fel, nucleele sau scheletul molecular ar fi mai puțin probabil să păstreze norul de electroni uniform tot timpul. Prin urmare, cu cât cercurile verzi considerate în A, B și C sunt mai mari, cu atât vor fi mai polarizabile și cu atât vor fi mai mari interacțiunile lor de către forțele londoneze..
Acest efect este clar observat între B și C și ar putea fi cu atât mai mult cu cât cercurile ar avea un diametru mai mare. Acest raționament este esențial pentru explicarea proprietăților fizice ale multor compuși pe baza maselor lor moleculare..
Exemple de forțe londoneze

În natură
În viața de zi cu zi există nenumărate exemple de forțe de dispersie ale Londrei, fără a se aventura în lumea microscopică în primul rând..
Unul dintre cele mai frecvente și surprinzătoare exemple se găsește în picioarele reptilelor cunoscute sub numele de geckos (imaginea de sus) și în multe insecte (de asemenea, în Spiderman).
Pe picioare au tampoane din care ies mii de filamente mici. În imagine puteți vedea un gecko care pozează pe panta unei stânci. Pentru a realiza acest lucru, folosește forțele intermoleculare dintre rocă și filamentele picioarelor sale..
Fiecare dintre aceste filamente interacționează slab cu suprafața pe care urcă mica reptilă, dar, din moment ce există mii, exercită o forță proporțională cu aria picioarelor lor, suficient de puternică încât să rămână atașate și să poată urca. Geckos sunt, de asemenea, capabili să urce pe suprafețe netede și perfecte, cum ar fi sticla..
Alcani
Alcanii sunt hidrocarburi saturate care interacționează și de către forțele londoneze. Structurile lor moleculare constau pur și simplu din carboni și hidrogeni uniți prin legături simple. Deoarece diferența de electronegativități între C și H este foarte mică, acestea sunt compuși apolari.
Astfel, metanul, CH4, cea mai mică hidrocarbură dintre toate, fierbe la -161,7ºC. Deoarece C și H sunt adăugați la schelet, se obțin alți alcani cu mase moleculare mai mari.
În acest fel, apar etanul (-88,6ºC), butanul (-0,5ºC) și octanul (125,7ºC). Observați cum punctele lor de fierbere cresc pe măsură ce alcanii se îngreunează.
Acest lucru se datorează faptului că norii lor electronici sunt mai polarizabili și structurile lor au o suprafață mai mare, ceea ce crește contactul dintre moleculele lor..
Octanul, deși este un compus apolar, are un punct de fierbere mai mare decât apa.
Halogeni și gaze
Forțele londoneze sunt prezente și în multe substanțe gazoase. De exemplu, moleculele de NDouă, HDouă, CODouă, FDouă, ClDouă și toate gazele nobile, interacționează prin aceste forțe, deoarece prezintă o distribuție electrostatică omogenă, care poate suferi dipoli instantanee și poate da naștere la polarizări.
Gazele nobile sunt He (heliu), Ne (neon), Ar (argon), Kr (kripton), Xe (xenon) și Rn (radon). De la stânga la dreapta, punctele lor de fierbere cresc odată cu creșterea masei atomice: -269, -246, -186, -152, -108 și -62 ° C.
Halogenii interacționează și prin aceste forțe. Fluorul este un gaz la temperatura camerei la fel ca clorul. Bromul, cu o masă atomică mai mare, se găsește în condiții normale ca un lichid roșiatic, iar iodul, în cele din urmă, formează un solid purpuriu care se sublimă rapid, deoarece este mai greu decât alți halogeni.
Referințe
- Whitten, Davis, Peck și Stanley. Chimie. (Ed. A VIII-a). CENGAGE Learning, p 452-455.
- Angeles Mendez. (22 mai 2012). Forțe de dispersie (din Londra). Recuperat de pe: quimica.laguia2000.com
- Forțele de dispersie din Londra. Recuperat de la: chem.purdue.edu
- Helmenstine, Anne Marie, dr. (22 iunie 2018). 3 tipuri de forțe intermoleculare. Recuperat de pe: thoughtco.com
- Ryan Ilagan și Gary L Bertrand. Interacțiuni de dispersie la Londra. Preluat de pe: chem.libretexts.org
- ChemPages Netorials. Forțele din Londra. Recuperat de la: chem.wisc.edu
- Kamereon. (22 mai 2013). Geckos: Gecko și forțele lui Van der waals. Recuperat de pe: almabiologica.com


Nimeni nu a comentat acest articol încă.