
Caracteristici, nomenclatură, utilizări și exemple de hidracide

hidracizi sau acizii binari sunt compuși dizolvați în apă care sunt compuși din hidrogen și un element nemetalic: halogenuri de hidrogen. Formula sa chimică generală poate fi exprimată ca HX, unde H este atomul de hidrogen, iar X este elementul nemetalic..
X poate aparține grupului 17, halogenilor sau elementelor grupului 16 fără a include oxigenul. Spre deosebire de acizii oxo, hidrații nu au oxigen. Deoarece hidracizii sunt compuși covalenți sau moleculari, trebuie luată în considerare legătura H-X. Acest lucru este de o mare importanță și definește caracteristicile fiecărui hidracid..
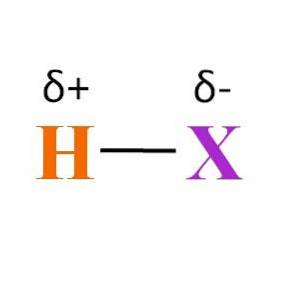
Dar legătura H-X? După cum se poate vedea în imaginea de mai sus, există un moment dipol permanent produs de diferite electronegativități între H și X. Deoarece X este de obicei mai electronegativ decât H, își atrage norul electronic și se termină cu o încărcare parțială negativă δ-.
Pe de altă parte, dând o parte din densitatea sa de electroni lui X, se termină cu o sarcină parțială pozitivă δ +. Cu cât δ- este mai negativ, cu atât va fi mai bogat în electroni X și cu atât este mai mare deficiența de electroni a lui H. Prin urmare, în funcție de elementul X, un hidracid poate fi mai mult sau mai puțin polar.
Imaginea dezvăluie, de asemenea, structura hidraților. H-X este o moleculă liniară, care poate interacționa cu alta la unul dintre capetele sale. Cu cât HX este mai polar, cu atât moleculele sale vor interacționa mai puternic sau cu afinitate. Ca urmare, punctele sale de fierbere sau topire vor crește.
Cu toate acestea, interacțiunile H-X - H-X sunt încă suficient de slabe pentru a da naștere unui hidracid solid. Din acest motiv, în condiții de presiune și temperatură ambiantă sunt substanțe gazoase; Cu excepția HF, care se evaporă peste 20 ° C.
De ce? Deoarece HF este capabil să formeze legături puternice de hidrogen. În timp ce ceilalți hidrați, ale căror elemente nemetalice sunt mai puțin electronegative, cu greu pot fi în faza lichidă sub 0 ° C. HCl, de exemplu, fierbe la aproximativ -85 ° C.
Hidrații sunt substanțe acide? Răspunsul constă în sarcina parțială pozitivă δ + pe atomul de hidrogen. Dacă δ + este foarte mare sau legătura H-X este foarte slabă, atunci HX va fi un acid puternic; ca și în cazul tuturor hidroacizilor halogeni, odată ce halogenurile lor respective sunt dizolvate în apă.
Indice articol
- 1 Caracteristici
- 1.1 Fizic
- 1.2 Chimie
- 2 Nomenclatură
- 2.1 Forma anhidră
- 2.2 În soluție apoasă
- 3 Cum sunt formate?
- 3.1 Dizolvarea directă a halogenurilor de hidrogen
- 3.2 Dizolvarea sărurilor nemetalice cu acizi
- 4 utilizări
- 4.1 Detergenți și solvenți
- 4.2 Catalizatori acizi
- 4.3 Reactivi pentru sinteza compușilor organici și anorganici
- 5 Exemple
- 5.1 HF, acid fluorhidric
- 5.2 H2S, hidrogen sulfurat
- 5.3 HCI, acid clorhidric
- 5.4 HBr, acid bromhidric
- 5.5 H2Te, acid telurhidric
- 6 Referințe
Caracteristici
Fizic
-Vizibil, toți hidracizii sunt soluții transparente, deoarece HX sunt foarte solubili în apă. Pot avea tonuri gălbui în funcție de concentrațiile de HX dizolvat.
-Sunt fumători, ceea ce înseamnă că degajă fum dens, coroziv și iritant (unii dintre ei sunt chiar greață). Acest lucru se datorează faptului că moleculele HX sunt foarte volatile și interacționează cu vaporii de apă din mediul din jurul soluțiilor. Mai mult, HX în formele sale anhidre sunt compuși gazoși..
-Hidracizii sunt buni conductori ai electricității. Deși HX sunt specii gazoase în condiții atmosferice, atunci când sunt dizolvate în apă, eliberează ioni (H+X-), care permit trecerea curentului electric.
-Punctele sale de fierbere sunt mai mari decât cele ale formelor sale anhidre. Adică, HX (ac), care denotă hidracidul, fierbe la temperaturi peste HX (g). De exemplu, clorura de hidrogen, HCI (g), fierbe la -85 ° C, dar acidul clorhidric, acidul său, în jur de 48 ° C..
De ce? Deoarece moleculele gazoase HX sunt înconjurate de cele ale apei. Două tipuri de interacțiuni pot apărea în același timp: legături de hidrogen, HX - HDouăO - HX sau solvatare ionică, H3SAU+(ac) și X-(ac). Acest fapt este direct legat de caracteristicile chimice ale hidraților..
Chimic
Hidracizii sunt soluții foarte acide, deci au protoni H acizi3SAU+ disponibile pentru a reacționa cu alte substanțe. Unde face H3SAU+? Din atomul de hidrogen cu o sarcină parțială pozitivă δ +, care se disociază în apă și ajunge să fie încorporat covalent într-o moleculă de apă:
HX (aq) + HDouăO (l) <=> X-(ac) + H3SAU+(ac)
Rețineți că ecuația corespunde unei reacții care stabilește un echilibru. Când formarea lui X-(ac) + H3SAU+(ac) este foarte favorizat termodinamic, HX își va elibera protonul acid în apă; și apoi acesta, cu H3SAU+ ca nou „purtător”, poate reacționa cu un alt compus, chiar dacă acesta din urmă nu este o bază puternică.
Cele de mai sus explică caracteristicile acide ale hidraților. Acesta este cazul tuturor HX dizolvate în apă; dar unele generează soluții mai acide decât altele. Pentru ce este asta? Motivele pot fi foarte complicate. Nu toate HX (ac) favorizează echilibrul anterior spre dreapta, adică spre X-(ac) + H3SAU+(ac).
Aciditate
Iar excepția se observă în acidul fluorhidric, HF (aq). Fluorul este foarte electronegativ, prin urmare, scurtează distanța legăturii H-X, întărind-o împotriva descompunerii sale prin acțiunea apei..
La fel, legătura H-F are o suprapunere mult mai bună din motive de rază atomică. Pe de altă parte, legăturile H-Cl, H-Br sau H-I sunt mai slabe și au tendința de a se disocia complet în apă, până la ruperea echilibrului ridicat mai sus..
Acest lucru se datorează faptului că ceilalți halogeni sau calcogeni (sulf, de exemplu), au raze atomice mai mari și, prin urmare, orbitali mai mari. În consecință, legătura H-X prezintă o suprapunere orbitală mai slabă, deoarece X este mai mare, care la rândul său afectează forța acidă atunci când este în contact cu apa..
În acest fel, ordinea descrescătoare a acidității pentru hidroacizii halogenilor este următoarea: HF< HCl Cum se numesc hidracizii? În formele lor anhidre, HX (g), acestea trebuie menționate ca fiind dictate pentru halogenurile de hidrogen: adăugarea sufixului -ide la sfârșitul numelor lor. De exemplu, HI (g) constă dintr-o halogenură (sau hidrură) formată din hidrogen și iod, de aceea numele său este: iodzimbru hidrogen. Deoarece nemetalele sunt în general mai electronegative decât hidrogenul, are un număr de oxidare de +1. În NaH, pe de altă parte, hidrogenul are un număr de oxidare de -1. Acesta este un alt mod indirect de diferențiere a hidrurilor moleculare de halogeni sau halogenuri de hidrogen de alți compuși.. Odată ce HX (g) intră în contact cu apa, este reprezentat ca HX (ac) și apoi avem hidracidul. Pentru a denumi hidracidul, HX (ac), sufixul -ide al formelor sale anhidre trebuie înlocuit cu sufixul -hidric. Și ar trebui menționați ca acizi în primul rând. Astfel, pentru exemplul de mai sus, HI (ac) este denumit ca: iod acidhidrică. Hidracizii se pot forma prin simpla dizolvare a halogenurilor de hidrogen corespunzătoare în apă. Aceasta poate fi reprezentată de următoarea ecuație chimică: HX (g) => HX (ac) HX (g) este foarte solubil în apă, deci nu există un echilibru de solubilitate, spre deosebire de disocierea sa ionică pentru a elibera protoni acizi. Cu toate acestea, există o metodă sintetică care este preferată deoarece folosește săruri sau minerale ca materie primă, dizolvându-le la temperaturi scăzute cu acizi puternici.. Dacă sarea de masă, NaCI, este dizolvată cu acid sulfuric concentrat, apare următoarea reacție: NaCI (s) + HDouăSW4(aq) => HCI (aq) + NaHSO4(ac) Acidul sulfuric donează unul dintre protonii săi acizi anionului clorură Cl-, transformându-l astfel în acid clorhidric. Clorura de hidrogen, HCI (g), poate scăpa din acest amestec, deoarece este foarte volatil, mai ales dacă concentrația sa în apă este foarte mare. Cealaltă sare produsă este sulfatul acidului de sodiu, NaHSO4. O altă modalitate de producere a acestuia este înlocuirea acidului sulfuric cu acidul fosforic concentrat: NaCI (s) + H3PO4(aq) => HCI (aq) + NaHDouăPO4(ac) H3PO4 reacționează la fel ca HDouăSW4, producând acid clorhidric și fosfat diacid de sodiu. NaCl este sursa anionului Cl-, astfel încât pentru a sintetiza ceilalți hidrați, sunt necesare săruri sau minerale care conțin F-, Fr-, Eu-, SDouă-, etc.. Dar, utilizarea lui HDouăSW4 sau H3PO4 va depinde de puterea sa oxidativă. HDouăSW4 Este un agent oxidant foarte puternic, până la punctul în care oxidează chiar și Br- și eu- la formele lor moleculare BrDouă și euDouă; primul este un lichid roșiatic, iar al doilea un solid violet. Prin urmare, H3PO4 reprezintă alternativa preferată în astfel de sinteze. Hidracizii sunt folosiți în esență pentru a dizolva diferite tipuri de materii. Acest lucru se datorează faptului că sunt acizi puternici și pot curăța cu ușurință orice suprafață.. Protonii săi acizi sunt adăugați la compușii de impurități sau murdărie, făcându-i solubili în mediul apos și sunt apoi târâți de apă. În funcție de natura chimică a suprafeței menționate, se poate utiliza un hidracid sau altul. De exemplu, acidul fluorhidric nu poate fi utilizat pentru curățarea sticlei, deoarece le va dizolva pe loc. Acidul clorhidric este utilizat pentru îndepărtarea petelor de pe faianța piscinei. De asemenea, sunt capabili să dizolve roci sau probe solide și apoi utilizate în scopuri analitice sau de producție pe scări mici sau mari. În cromatografia cu schimb de ioni, acidul clorhidric diluat este utilizat pentru a curăța coloana de ioni rămași.. Unele reacții necesită soluții extrem de acide pentru a le accelera și a reduce timpul în care au loc. Aici intră hidracizii. Un exemplu în acest sens este utilizarea acidului hidroiodic în sinteza acidului acetic glacial. Industria petrolieră are nevoie și de hidrați în procesele de rafinărie. Hidracizii oferă nu numai protoni acizi, ci și anionii lor respectivi. Acești anioni pot reacționa cu un compus organic sau anorganic pentru a forma o halogenură specifică. În acest fel, ele pot fi sintetizate: fluoruri, cloruri, ioduri, bromuri, selenide, sulfuri și alți compuși mai mult. Aceste halogenuri pot avea aplicații foarte diverse. De exemplu, acestea pot fi utilizate pentru a sintetiza polimeri, cum ar fi teflon; sau intermediari, de la care atomii de halogen vor fi încorporați în structurile moleculare ale anumitor medicamente. Să presupunem că molecula CH3CHDouăOH, etanolul, reacționează cu HCI pentru a forma clorură de etil: CH3CHDouăOH + HCI => CH3CHDouăCl + HDouăSAU Fiecare dintre aceste reacții ascunde un mecanism și multe aspecte care sunt luate în considerare în sinteze organice.. Nu există multe exemple disponibile pentru hidrați, deoarece numărul de compuși posibili este limitat în mod natural. Din acest motiv, mai mulți hidracizi suplimentari sunt enumerați mai jos cu nomenclatura lor respectivă (abrevierea (ac) este ignorată): Hidracid binar ale cărui molecule H-F formează legături puternice de hidrogen, până la punctul în care în apă este un acid slab. Spre deosebire de hidracizii luați în considerare până atunci, acesta este poliatomic, adică are mai mult de doi atomi, totuși, continuă să fie binar, deoarece este vorba de două elemente: sulf și hidrogen.. Moleculele sale unghiulare H-S-H nu formează legături de hidrogen apreciabile și pot fi detectate prin mirosul lor caracteristic de ou stricat.. Unul dintre cei mai cunoscuți acizi din cultura populară. Face chiar parte din compoziția sucului gastric, prezent în stomac și, împreună cu enzimele digestive, degradează alimentele. La fel ca acidul hidroiodic, în faza gazoasă este format din molecule liniare H-Br, care se disociază în ioni H+ (H3SAU+) și fr- când intră în apă. Deși telurul are un anumit caracter metalic, hidracidul său degajă vapori neplăcuți și foarte otrăvitori, cum ar fi selenura de hidrogen.. Ca și ceilalți hidracizi ai calcogenidelor (din grupul 16 al tabelului periodic), în soluție produce anionul TeDouă-, deci valența sa este -2.Nomenclatură
Formă anhidră
În soluție apoasă
Cum sunt formate?
Dizolvarea directă a halogenurilor de hidrogen
Dizolvarea sărurilor nemetalice cu acizi
Aplicații
Detergenți și solvenți
Catalizatori acizi
Reactivi pentru sinteza compușilor organici și anorganici
Exemple
HF, acid fluorhidric
HDouăS, hidrogen sulfurat
HCI, acid clorhidric
HBr, acid bromhidric
HDouăTe, acid telurhidric
Referințe



Nimeni nu a comentat acest articol încă.