
Proprietăți, reactivitate și utilizări ale hidrurii de calciu (CaH2)

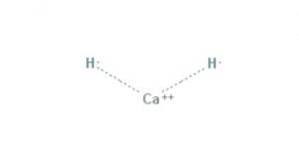
hidrură de calciu Este un compus chimic cu formula CaH2, care îl face o hidrură alcalino-pământoasă. Acest compus chimic are două legături ionice între calciu și cei doi ioni hidrură, așa cum se arată în figura 1.
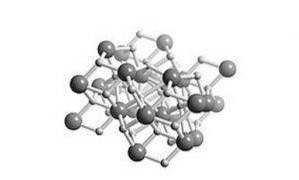
Este o hidrură salină, ceea ce înseamnă că structura sa este similară cu sarea. Structura sa cristalină este aceeași cu cea a clorurii de plumb (mineral de cotunnită) așa cum se arată în figura 2.
Toate metalele alcaline și alcalino-pământoase formează săruri de hidrură. În chimie, o hidrură este anionul de hidrogen, H- sau, mai frecvent, este un compus în care unul sau mai mulți centri de hidrogen au proprietăți nucleofile, reducătoare sau bazice.
La compușii care sunt considerați hidruri, atomul de hidrogen este atașat la un element sau grup mai electropozitiv.
Poate fi produs prin reacția calciului și hidrogenului la o temperatură cuprinsă între 300 și 400 de grade Celsius. O altă modalitate de preparare a hidrurii de calciu este încălzirea clorurii de calciu împreună cu hidrogen și sodiu metalic. Reacția are loc după cum urmează:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
În această reacție, calciu (Ca) și hidrogen (H) creează o moleculă de hidrură de calciu, în timp ce atomii de sodiu împreună cu clorul creează molecule de clorură de sodiu (NaCl)..
Hidrura de calciu poate fi produsă și prin reducerea oxidului de calciu (CaO) cu magneziu (Mg). Reacția se efectuează în prezența hidrogenului. Această reacție produce, de asemenea, oxid de magneziu (MgO). Mai jos este formula pentru această reacție chimică:
CaO + Mg + H2 → CaH2 + MgO
Indice articol
- 1 Proprietățile fizice și chimice ale hidrurii de calciu
- 2 Reactivitate și pericole
- 3 Manipulare și depozitare
- 4 Utilizări și aplicații
- 4.1 Agent deshidratant
- 4.2 Producția de hidrogen
- 4.3 Agent de reducere
- 5 Dezavantaj în utilizarea hidrurii de calciu
- 6 Referințe
Proprietățile fizice și chimice ale hidrurii de calciu
Hidrura de calciu este un set de cristale cu o structură ortorombică de culoare albă atunci când este pură. În general, este rar să îl găsiți în această formă, astfel încât are de obicei o nuanță cenușie. Îi lipsește un miros caracteristic. Aspectul său este prezentat în figura 3 (Societatea Regală de Chimie, 2015).

Are o greutate moleculară de 42,094 g / mol, are un punct de topire de 816 grade Celsius și o densitate de 1,70 g / ml. Dacă se dizolvă în apă reacționează violent producând hidrogen. De asemenea, reacționează cu alcoolul (Centrul Național pentru Informații despre Biotehnologie., S.F.).
Reactivitate și pericole
Hidrura de calciu este o substanță chimică stabilă, deși este foarte reactivă la apă sau umezeală. În contact cu apa, eliberează gaze de hidrogen inflamabile care se pot aprinde spontan.
Este considerat un compus exploziv. Când este încălzit într-o reacție cu tetrahidrofuran, poate provoca o explozie. Când este amestecat cu clorat, hipoclorit, bromat, perclorat de potasiu, devine sensibil la căldură, frecare și devine exploziv (hidrură de calciu 7789-78-8, 2016).
Când fluorura de argint este zdrobită cu hidrură de calciu, masa devine incandescentă. Încălzirea puternică a hidrurii cu clor, brom sau iod duce la incandescență.
Amestecurile de hidrură cu diferiți bromați, de exemplu bromatul de bariu sau clorații, de exemplu cloratul de bariu și perclorații, cum ar fi percloratul de potasiu, explodează la măcinare. CaH2 reacționează incandescent cu fluorura de argint dacă este supusă fricțiunii.
Acest compus trebuie manipulat într-o atmosferă inertă. Dacă nu este manipulat corespunzător, acesta poate reprezenta o amenințare gravă pentru sănătatea și siguranța personalului de laborator, a celor care primesc primul răspuns și a manipulatorilor de deșeuri chimice (Centrul UC pentru siguranță în laborator, 2013).
Extrem de periculos în caz de contact cu pielea sau ochii, deoarece este iritant. Foarte periculos în caz de contact cu pielea, deoarece poate fi coroziv.
De asemenea, este periculos în caz de ingestie și inhalare. Cantitatea de leziuni tisulare depinde de lungimea contactului. Contactul cu ochii poate duce la deteriorarea corneei sau la orbire..
Contactul cu pielea poate provoca inflamații și vezicule. Inhalarea prafului va provoca iritarea tractului gastro-intestinal sau respirator, caracterizată prin arsură, strănut și tuse..
Supraexpunerea severă poate duce la leziuni pulmonare, sufocare, inconștiență și chiar moarte. Inflamația ochiului se caracterizează prin roșeață, udare și mâncărime. Inflamația pielii se caracterizează prin mâncărime, peeling, roșeață sau ocazional vezicule.
Expunerea repetată la nivel scăzut a ochilor poate provoca iritarea ochilor. Expunerea repetată a pielii poate provoca distrugerea locală a pielii sau dermatită..
Inhalarea repetată a prafului poate produce diferite grade de iritație respiratorie sau leziuni pulmonare. Inhalarea repetată sau prelungită a prafului poate provoca iritații respiratorii cronice (Fișa tehnică de securitate a materialului Hidrura de calciu, MSDS, 2005).
În caz de contact cu ochii, aceștia trebuie clătiți imediat cu multă apă timp de cel puțin 15 minute, ridicând ocazional pleoapele superioare și inferioare..
În caz de contact cu pielea, clătiți imediat cu multă apă timp de cel puțin 15 minute în timp ce îndepărtați îmbrăcămintea și pantofii contaminați..
În caz de ingestie, vărsăturile nu trebuie induse. Ar trebui chemat un centru de control al otrăvurilor Este recomandabil să părăsiți locul de expunere și să vă deplasați imediat în aer liber.
În caz de inhalare, dacă respirația este dificilă, este necesar să se furnizeze oxigen. Resuscitarea gură la gură nu trebuie administrată dacă victima a înghițit sau a inhalat substanța..
Respirația artificială trebuie indusă cu ajutorul unei măști de buzunar prevăzută cu o supapă unidirecțională sau alt dispozitiv medical respirator adecvat. În toate cazurile, asistența medicală trebuie să fie imediat obținută..
Manipulare și depozitare
Compusul trebuie păstrat într-un recipient uscat, ferit de căldură. Ar trebui ținut departe de sursele de aprindere. Nu trebuie respirați praful. Nu trebuie adăugată apă la acest produs
În cazul unei ventilații insuficiente, purtați echipament respirator adecvat, cum ar fi o mască de filtrare. În caz de expunere, solicitați asistență medicală și afișați eticheta acolo unde este posibil. Evitați contactul cu pielea și ochii.
Materialele inflamabile, în general, trebuie depozitate într-un dulap de securitate separat sau într-o cameră de depozitare. Păstrați recipientul bine închis.
A se păstra într-un loc răcoros și bine ventilat. Toate echipamentele care conțin material trebuie să fie împământate pentru a evita scânteile electrice. Recipientul trebuie păstrat uscat și într-un loc răcoros.
Este un material neinflamabil. Cu toate acestea, pompierii ar trebui să poarte echipament adecvat în timp ce luptă împotriva unui incendiu în jurul acestui compus chimic..
Nu este recomandabil niciodată să folosiți apă pentru a stinge un incendiu în jurul hidrurii de calciu. Nisipul uscat, precum și compuși precum clorura de sodiu și carbonatul de sodiu pot fi folosiți în acest scop..
Pentru a elimina hidrura de calciu reziduală, aceasta trebuie descompusă prin adăugarea a 25 ml de metanol pentru fiecare gram de hidrură sub o atmosferă de azot în timp ce se agită..
Odată ce reacția este completă, același volum de apă este adăugat compusului apos de metoxid de calciu și este eliminat în canalizare cu multă apă (consiliul național de cercetare, 1995).
Utilizări și aplicații
Agent deshidratant
Hidrura de potasiu este un desicant relativ ușor. Din acest motiv, utilizarea acestui compus ca desicant este mai sigură în comparație cu agenți mai reactivi, cum ar fi aliajele de sodiu-potasiu și sodiu metalic. Reacționează cu apa după cum urmează:
CaH2 + 2 H2O → Ca (OH) 2 + 2 H2
Produsele de hidroliză ale acestei reacții, hidrogen (gaz) și Ca (OH) 2 (un amestec apos), pot fi separate de solventul chimic după un proces de filtrare, distilare sau decantare..
Acest compus chimic este un desicant eficient pentru mulți solvenți bazici, cum ar fi aminele și piridina. Uneori se folosește pentru pre-uscare a solvenților înainte de a utiliza mai mulți desecanți reactivi.
Producția de hidrogen
În anii 1940, acest compus era disponibil ca sursă de hidrogen sub denumirea comercială „Hydrolith”..
A fost folosit ca sursă de hidrogen de mult timp. Este încă folosit pentru a produce hidrogen pur în laboratoare pentru diferite experimente, celule de combustie avansate și aplicații pentru baterii (American Elements, S.F.).
Compusul a fost utilizat pe scară largă de zeci de ani ca un mijloc sigur și convenabil de umflare a baloanelor meteorologice..
De asemenea, este utilizat în mod regulat în laboratoare pentru a produce cantități mici de hidrogen foarte pur pentru experimente. Conținutul de umiditate al motorinei este calculat din hidrogenul dezvoltat după tratamentul cu CaH2.
Agent de reducere
Când este încălzit între 600 și 1000 de grade Celsius, oxidul de zirconiu, niobiul, uraniul, cromul, titanul, vanadiul și tantalul pot fi reduse pentru a prepara pulberea acestor metale, astfel încât hidrura de calciu poate fi utilizată în metalurgia prafului.
Următoarea reacție ilustrează modul în care hidrura de calciu acționează ca agent reducător:
TiO + 2CaH2 → CaO + H2 + Ti
Dezavantaj în utilizarea hidrurii de calciu
Acest compus chimic este adesea alegerea preferată ca agent de uscare; Cu toate acestea, are și unele dezavantaje:
-Acțiunea de uscare a acestui compus este lentă, deoarece nu este solubilă în niciun solvent cu care nu reacționează violent..
-Acest compus sub formă de pulbere este incompatibil cu mulți solvenți. Reacția sa cu clorocarburi poate provoca chiar explozii.
-Nu poate fi utilizat pentru solvenți de dezoxigenare, deoarece nu este capabil să îndepărteze oxigenul dizolvat.
-Diferențierea dintre hidrură de calciu și hidroxid de calciu este destul de dificilă datorită aspectelor lor similare.
Referințe
- Elemente americane. (S.F.). hidrură de calciu. Adus de pe americanelements.com: americanelements.com.
- Hidrura de calciu 7789-78-8. (2016). Adus de pe chemicalbook.com: chemicalbook.com.
- hidrură de calciu. (s.f.). Adus de la un cursant de chimie: chemistrylearner.com.
- Fișă tehnică de securitate a materialului hidrogen de calciu MSDS. (2005, 10 octombrie). Adus de la sciencelab.com: sciencelab.com.
- Centrul Național pentru Informații despre Biotehnologie. (S.F.). Baza de date compusă PubChem; CID = 105052. Adus de la pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- Consiliul national de cercetare. (o mie noua sute nouazeci si cinci). Practici prudente în laborator: manipularea și eliminarea substanțelor chimice. Washinton: NationalAacademy Press.
- Societatea Regală de Chimie. (2015). hidrură de calciu ID 94784. Adus de la chemspider.com: chemspider.com.
- Centrul UC pentru siguranța laboratorului. (2013, 18 ianuarie). procedura standard de operare hidrură de calciu. Adus de la chemengr.ucsb.edu: chemengr.ucsb.edu.



Nimeni nu a comentat acest articol încă.