
Proprietăți de hidrură de sodiu (NaH), reactivitate, pericole, utilizări

hidrură de sodiu Este un compus anorganic cu formula NaH. Are o legătură ionică între sodiu și hidrură. Structura sa este ilustrată în figura 1. Este reprezentativă pentru hidrurile saline, ceea ce înseamnă că este o hidrură asemănătoare sării, compusă din ioni Na + și H-, spre deosebire de mai multe hidruri moleculare precum boran, metan, amoniac și apă.
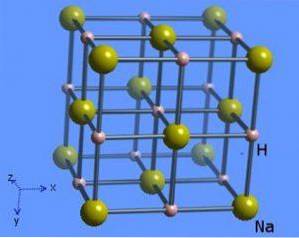
Structura cristalină are un număr de coordonare 6, unde fiecare moleculă de sodiu este înconjurată de 8 ioni de hidrură care prezintă o formă octaedrică și este ilustrată în figura 2 (Mark Winter [Universitatea din Sheffield și WebElements Ltd, 1993-2016).
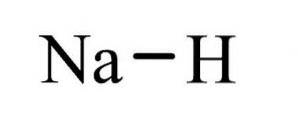
Compusul este preparat prin reacția directă dintre sodiu și hidrogen gazos (Formula hidrurii de sodiu - Utilizările, proprietățile, structura și formula hidrurii de sodiu, 2005-2017) după cum urmează:
H2 + 2Na → 2NaH
Hidrura de sodiu este vândută comercial sub formă de dispersie la 60% greutate / greutate (procent de greutate în greutate) în ulei mineral pentru manipulare sigură (HIDRID DE SODIU, n.d.).
Indice articol
- 1 Proprietățile fizice și chimice ale hidrurii de sodiu
- 2 Reactivitate și pericole
- 3 utilizări
- 4 Referințe
Proprietățile fizice și chimice ale hidrurii de sodiu
Hidrura de sodiu este un solid alb atunci când este pur, deși este în general de culoare gri sau argintiu. Aspectul său este prezentat în figura 3.

NaH are o greutate moleculară de 23,99771 g / mol, o densitate de 1,396 g / ml și un punct de topire de 800 ° C (Royal Society of Chemistry, 2015). Este insolubil în amoniac, benzen, tetraclorură de carbon și disulfură de carbon (National Center for Biotechnology Information, n.d.).
Compusul este extrem de instabil. NaH pur se poate aprinde cu ușurință în aer. Când intră în contact cu apa prezentă în aer, eliberează hidrogen foarte inflamabil.
Când este deschis aerului și umezelii, NaH se hidrolizează ușor în baza puternică corozivă a hidroxidului de sodiu (NaOH) pe baza reacției:
NaH + H2O → NaOH + H2
În această reacție se poate observa că hidrura de sodiu se comportă ca o bază. Acest lucru se datorează electronegativității.
Sodiul are o electronegativitate semnificativ mai mică (≈1,0) decât hidrogenul (≈2,1), ceea ce înseamnă că hidrogenul atrage densitatea electronilor către sine, îndepărtându-se de sodiu pentru a genera un cation de sodiu și o hidrură de anion.
Pentru ca un compus să fie un acid Brønsted, trebuie să separe densitatea electronică a hidrogenului, adică să îl conecteze la un atom electronegativ precum oxigenul, fluorul, azotul etc. Abia atunci poate fi descris oficial ca H + și poate fi disociat ca atare.
O hidrură este mult mai bine descrisă ca H- și are o pereche de electroni liberi. Ca atare, este o bază Brønsted, nu un acid. De fapt, dacă extindeți definiția acidului / bazei Brønsted așa cum a făcut Lewis, veți ajunge la concluzia că sodiul (Na +) este specia acidă aici..
Produsul de reacție Brønsted acid / bază din baza H- și acidul H + devine H2. Deoarece hidrogenul acid este extras direct din apă, hidrogenul gazos poate bulă, deplasând echilibrul chiar dacă reacția nu este favorizată termodinamic..
Pot rămâne ioni OH care se pot scrie cu restul cationului Na + pentru a da hidroxid de sodiu (De ce este hidrura de sodiu solidă o bază și nu un acid când reacționează cu apa?, 2016).
Reactivitate și pericole
Compusul este un agent de reducere puternic. Atacă SiO2 în sticlă. Se aprinde la contactul cu gazele F2, Cl2, Br2 și I2 (acesta din urmă la temperaturi peste 100 ° C), în special în prezența umidității, pentru a forma HF, HCl, HBr și HI.
Reacționează cu sulf pentru a da Na2S și H2S. Poate reacționa exploziv cu dimetil sulfoxid. Reacționează energic cu acetilena, chiar la -60 ° C. Este inflamabil spontan în fluor.
Inițiază o reacție de polimerizare în etil-2,2,3-trifluoropropionat, astfel încât esterul se descompune violent. Prezența în reacție a dietil succinat și trifluoroacetat de etil a provocat explozii (HIDRURA DE SODIU, 2016).
Hidrura de sodiu este considerată corozivă pentru piele sau ochi, datorită potențialului de produse secundare caustice ale reacțiilor cu apa..
În caz de contact cu ochii, aceștia trebuie clătiți cu cantități mari de apă, sub pleoape timp de cel puțin 15 minute și solicitați imediat asistență medicală..
În caz de contact cu pielea, periați imediat și clătiți zona afectată cu apă. Solicitați asistență medicală dacă iritația persistă..
Nociv dacă este înghițit din cauza reacției la apă. Nu provocați voma. Solicitați asistență medicală imediată și transferați victima la o unitate medicală..
Dispersia de ulei de hidrură de sodiu nu este pulbere. Cu toate acestea, materialul care reacționează poate emite o ceață fină caustică. În caz de inhalare, clătiți gura cu apă și scoateți victima la aer curat. Solicitați asistență medicală (Rhom și Hass inc., 2007).
Aplicații
Principala utilizare a hidrurii de sodiu este de a efectua reacții de condensare și alchilare care se dezvoltă prin formarea unui carbanion (catalizat de bază).
Hidrura de sodiu din ulei seamănă cu alcoolații de sodiu și metal metalici prin capacitatea sa de a funcționa ca agent deprotonant în esterul acetoacetic, condensările Claisen, Stobbe, Dieckmann și alte reacții conexe. Are avantaje marcate față de alți agenți de condensare prin faptul că:
- Este o bază mai puternică, ceea ce duce la o deprotonare mai directă.
- Nu este nevoie de exces.
- H2 produs produce o măsură a gradului de reacție.
- Reacțiile adverse precum reducerile sunt eliminate.
Alchilările aminelor aromatice și heterociclice, cum ar fi 2-aminopiridina și fenotiazina, se realizează cu ușurință cu randament ridicat folosind amestecuri toluen-metilformamidă. Concentrația de dimetilformamidă este o variabilă utilizată pentru controlul vitezei de reacție (HINCKLEY, 1957).
Utilizarea hidrurii de sodiu a fost propusă pentru depozitarea hidrogenului pentru utilizarea în vehiculele cu pile de combustie, hidrura fiind închisă în granule de plastic care sunt zdrobite în prezența apei pentru a elibera hidrogenul..
Referințe
- HINCKLEY, M. D. (1957). Fabricarea, manipularea și utilizările hidrurii de sodiu. Progresele în chimie, vol. 19, 106-117.
- Mark Winter [Universitatea din Sheffield și WebElements Ltd, U. (1993-2016). Sodiu: hidrură de sodiu. Adus de la WebElements: webelements.com.
- Centrul Național pentru Informații despre Biotehnologie. (s.f.). Baza de date compusă PubChem; CID = 24758. Adus de la PubChem: pubchem.ncbi.nlm.nih.gov.
- Rhom și Hass inc. (2007, decembrie). Hidrură de sodiu 60% dispersie în ulei. Adus de pe dow.com.
- Societatea Regală de Chimie. (2015). Hidrură de sodiu. Adus de la ChemSpider: chemspider.com.
- HIDRURA DE SODIU. (2016). Adus de la cameochemicals: cameochemicals.noaa.gov.
- Formula hidrurii de sodiu - Utilizările, proprietățile, structura și formula hidrurii de sodiu. (2005-2017). Adus de la Softschools.com: softschools.com.
- HIDRURA DE SODIU. (s.f.). Adus de la chemicalland21: chemicalland21.com.
- De ce hidrura solidă de sodiu este o bază și nu un acid când reacționează cu apa? (2016, 20 aprilie). Adus de la stackexchange: chemistry.stackexchange.com.


Nimeni nu a comentat acest articol încă.