
Structura hidroxidului de fier (II), proprietăți, utilizări
hidroxid de fier (II), numit și hidroxid feros, este un compus anorganic cu formula chimică Fe (OH)Două. Dacă puritatea ta este mare, solidul tău constă numai din ioni FeDouă+ și OH- într-un raport 2: 1; cu toate acestea, poate conține molecule de apă și diferite specii ionice, schimbând poziția.
Reprezintă forma „redusă” a celebrului ruginiu, o suprafață roșiatică compusă din ioni Fe.3+; în timp ce în rugină verzuie predomină FeDouă+, lângă OH- și alte cantități de anioni: CO3Două-, SW4Două-, NU3- și halogenuri (F-, Cl-,… ), de exemplu. Rezultatul, deși baza acestei rugini verzi este Fe (OH)Două, este că se obțin diverse solide.

În viața de zi cu zi acest hidroxid poate fi văzut în locuri comune. De exemplu, barca din imaginea de mai sus are suprafața acoperită de rugină verde (nu patină). Există Credința (OH)Două, dar însoțit de numeroși ioni de pe valurile mării.
Din punct de vedere chimic, proprietățile și utilizările acestui material depind de cationul Fe.Două+ și tendința sa de oxidare pentru a deveni Fe3+. Este un agent reducător, care reacționează rapid cu oxigenul în condiții de bază. Prin urmare, trebuie utilizat în atmosfere inerte și în soluții acide..
Indice articol
- 1 Structura hidroxidului de fier (II)
- 1.1 Legături
- 1.2 Straturi duble de hidroxid
- 1.3 Hidrați
- 1.4 Rugina verde și roșie
- 2 Proprietăți
- 3 utilizări
- 3.1 Analiza organică calitativă
- 3.2 Reductor de oxoanion de seleniu
- 3.3 Materiale cu strat dublu
- 4 Referințe
Structura hidroxidului de fier (II)
Link-uri
Având în vedere doar Fe (OH)Două pur, nu are altceva decât ioni FeDouă+ și OH-.
Interacțiunile dintre ele trebuie, în teorie, să fie de natură ionică; fiecare cation FeDouă+ atrage doi anioni OH-, ale cărei atracții nedirecționale ajung să stabilească o ordine structurală și repetitivă care definește un cristal; care la rândul său, dă naștere la praf de rugină verde.
Problema este că există un anumit caracter covalent între ambii ioni și, prin urmare, o legătură ionică Fe-OH nu poate fi ignorată. Având în vedere o legătură Fe-OH parțial ionică, se poate înțelege că acestea sunt grupate într-un fel de strat polimeric.
Straturi duble de hidroxid
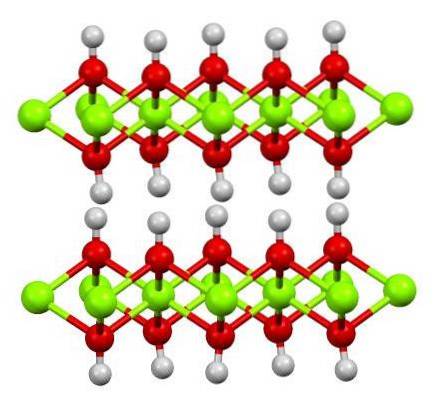
Structura hidroxidului feros pur este prezentată mai sus cu un model cu bile și lipici. Cationii FeDouă+ sunt reprezentate de sferele verzi strălucitoare, în timp ce anionii OH- de sferele roșii și albe. Observați cum se aliniază ionii FeDouă+ datorită interacțiunilor (ionic-covalente) cu OH-.
De ce această structură se numește straturi de hidroxid dublu? Imaginea în sine oferă răspunsul: există două rânduri sau straturi de OH- pentru fiecare dintre CredințăDouă+; adică se menține raportul 2: 1 al Fe (OH)Două menționată la început.
Unități structurale pentru Fe (OH)Două sunt atunci aceste sandvișuri, unde straturile de OH- ar veni să reprezinte pâinile; pâini încărcate negativ care, prin urmare, nu reușesc să se stabilească corect pentru a defini un cristal maro izbitor.
Dar, pe de altă parte, atomii H se aliniază și se umbresc reciproc. Amintindu-ne conceptul de polaritate și electronegativitate, acești hidrogeni au o ușoară încărcare parțială pozitivă, δ +; care, deși slabă, poate avea o zonă pozitivă în care sunt adăpostiți alți anioni sau molecule.
Hidratați
Când Fe (OH)Două se dizolvă în apă, moleculele sale se coordonează cu centrul metalic al FeDouă+ pentru a forma un complex apos: [Fe (HDouăSAU)4(OH)Două]. Acest complex are o geometrie octaedrică, deoarece are șase liganzi: patru molecule de apă și două molecule OH.-. Cu toate acestea, în hidroxidul de fier hidratat imaginea este puțin diferită..
În hidrat, cu formula ipotetică Fe (OH)DouăNHDouăSau, moleculele de apă sunt adăpostite exact între cele două straturi de hidroxid; adică interacționează prin forțe dipol-ionice cu hidrogeni sau sfere albe. Este ca și cum s-ar fi luat două sandvișuri OHFeOH și s-ar introduce apă pentru a le grupa: OHFeOH (HDouăO) OHFeOH.
Moleculele de apă sunt foarte dinamice, împiedicând particulele de hidrat să capete dimensiuni considerabile și, în consecință, formează un solid coloidal sau gelatinos..
Rugina verde si rosie
În hidrați straturile de hidroxid au molecule de apă intercalate; cu toate acestea, pot avea alți anioni (deja menționați), provocând o mare varietate de rugini verzi. La fel, pot chiar „prinde” molecule la fel de mari ca ADN-ul sau medicamentele.
Ionii Fe nu numai că pot fi prezențiDouă+, dar și Credință3+, produs al oxidării interne cauzate de oxigenul intercalat. S-ar observa vizibil că rugina verde (sau oxidul) începe să devină roșiatică odată cu creșterea concentrației de Fe.3+.
Proprietăți

Fe (OH) prezentat mai susDouă precipitat într-o eprubetă. Fiind în apă abundentă, apele complexe ar trebui să predomine asupra structurii menționate anterior. Observați că suprafața prezintă o culoare portocalie, un produs al oxidării FeDouă+ către Credință3+ de oxigenul din aer; adică acest hidroxid este un agent reducător:
CredinţăDouă+ <=> Credinţă3+ + și-
Aspectul fizic al acestui compus în stare pură este cel al unui solid maro:

Care, în funcție de nivelul de umiditate, poate apărea ca un solid de culoare verde jeleu. Este destul de insolubil în apă (Ksp= 8 10-16 și solubilitate = 0,72 g / 100 ml la 25 ° C) și are o masă molară de 89,86 g / mol și o densitate de 3,4 g / ml.
Nu sunt raportate puncte de fierbere sau topire pentru acest compus; probabil datorită faptului că, înainte de o sursă de căldură, aceasta se deshidratează și se transformă în oxid feros, FeO:
Fe (OH)Două => FeO + HDouăSAU
Aplicații
Analiza organică calitativă
Puterea sa de reducere este utilizată pentru a determina prezența compușilor nitro, RNODouă. Reacția pentru care se obține un test pozitiv este reprezentată de următoarea ecuație chimică:
RNODouă + 6Fe (OH)Două + 4HDouăO => RNHDouă + 6Fe (OH)3
Fe (OH)3 precipită sub forma unui solid maroniu-roșcat, care certifică prezența grupării nitro, -NODouă.
Reductor de oxoanion de seleniu
Puterea de reducere a Fe (OH)Două a fost de asemenea folosit pentru a reduce anionii SeO3Două- (selenit) și SeO4Două- (selenat) la seleniu elementar, Se. Practic, permite îndepărtarea unor astfel de anioni, dăunători sănătății, sub forma unui solid de seleniu insolubil și ușor de extras.
Materiale cu strat dublu
Structura sa pură și rugina verde sunt o sursă de inspirație pentru proiectarea de noi materiale cu caracteristici mineralogice..
Se estimează că funcția lor este de a permite transportul unei specii specifice între straturile acesteia, în așa fel încât eliberarea acesteia la locul activ (soluri, celule, suprafață metalică etc.) poate fi controlată sau redusă..
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Hidroxid de fier (II). Recuperat de pe: en.wikipedia.org
- Centrul Național pentru Informații despre Biotehnologie. (2019). Hidroxid feros. Baza de date PubChem. CID = 10129897. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Nick Doe. (s.f.). Teste pentru fenoli și nitro grupuri. Chimie 211. Recuperat de la: academics.wellesley.edu
- Clark Jim. (27 aprilie 2019). Chimia fierului. Chimie LibreTexte. Recuperat de pe: chem.libretexts.org
- Software tehnic Kingston. (2019). Chimia ruginii. Medici coroziune. Recuperat de pe: corrosion-doctors.org
- Zingaro, Ralph A. și colab. (1997). Reducerea anionilor oxoseleniu prin hidroxid de fier (II). Environment International. 23 (3): 299-304. doi: 10.1016 / S0160-4120 (97) 00032-9


Nimeni nu a comentat acest articol încă.