
Structura hidroxidului de magneziu, proprietăți, nomenclatură, utilizări
hidroxid de magneziu este un compus anorganic a cărui formulă chimică este Mg (OH)Două. În forma sa pură este un solid alb plictisitor cu aspect amorf; Cu toate acestea, cu un conținut mic și exact de impurități, se transformă în brucită solidă cristalină, un mineral care se găsește în anumite depozite din natură și este o sursă bogată de magneziu..
Este un electrolit sau o bază slabă, astfel încât disocierea sa este scăzută în apă. Această proprietate face Mg (OH)Două un bun neutralizator al acidității pentru consumul uman; remediu cunoscut popular ca suspensie de lapte de magnezie. De asemenea, este un ignifug prin eliberarea de apă în timpul descompunerii sale termice..

În imaginea superioară sunt prezentate câteva solide de hidroxid de magneziu, în care culoarea sa albă opacă poate fi apreciată. Cu cât sunt mai cristaline, dezvoltă suprafețe sticloase și sidefate.
Structura sa cristalină este deosebită, deoarece stabilește cristale hexagonale cu două straturi, care sunt modele promițătoare pentru proiectarea de noi materiale. În aceste straturi, sarcinile lor pozitive joacă un rol important datorită înlocuirii MgDouă+ de cationi trivalenți, iar speciile limitate între pereții compuși din anioni OH-.
Pe de altă parte, alte aplicații derivă în funcție de morfologia particulelor sau nanoparticulelor preparate; ca catalizatori sau adsorbanti. În toate acestea, raportul 1: 2 pentru ioni Mg este menținut constant.Două+: OH-, reflectată în aceeași formulă Mg (OH)Două.
Indice articol
- 1 Structură
- 1.1 Formula și octaedrul
- 1.2 Dublu strat
- 1.3 Morfologii
- 2 Proprietăți
- 2.1 Aspect fizic
- 2.2 Masa molară
- 2.3 Densitatea
- 2.4 Punct de topire
- 2.5 Solubilitate în apă
- 2.6 Indicele de refracție
- 2,7 pH
- 2.8 Capacitatea de căldură
- 3 Unde se află?
- 4 Nomenclatură
- 5 utilizări
- 5.1 Neutralizator
- 5.2 Antiacid
- 5.3 ignifug
- 5.4 Catalizator
- 5.5 Adsorbant
- 6 Referințe
Structura
Formula și octaedrul
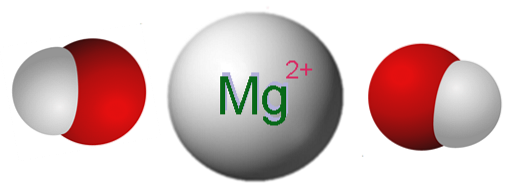
Imaginea de mai sus prezintă ionii care alcătuiesc Mg (OH)Două. După cum se poate vedea, există doi anioni OH- pentru fiecare cation MgDouă+, care interacționează electrostatic pentru a defini un cristal cu o structură hexagonală. Aceeași formulă indică faptul că raportul Mg: OH este 1: 2.
Cu toate acestea, adevărata structură cristalină este puțin mai complicată decât presupunerea unor ioni Mg simpli.Două+ și OH-. De fapt, magneziul se caracterizează prin faptul că are un număr de coordonare de 6, deci poate interacționa cu până la șase OH-.
Astfel, se formează octaedrul Mg (OH)6, unde atomii de oxigen provin evident din OH-; iar structura cristalină se bazează acum pe considerarea unor astfel de octaedre și modul în care acestea interacționează între ele.
De fapt, unitățile Mg (OH)6 sfârșesc prin definirea structurilor cu două straturi care, la rândul lor, sunt dispuse în spațiu pentru a provoca cristalul hexagonal.
Strat dublu
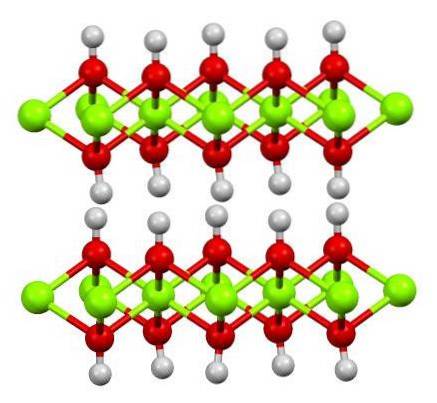
Imaginea superioară arată structura cu dublu strat de hidroxid de magneziu (LDH): Hidroxid dublu stratificat). Sferele verzi reprezintă ionii MgDouă+, care ar putea fi înlocuită de altele cu o sarcină mai mare pentru a genera o sarcină pozitivă în strat.
Rețineți că în jurul fiecărui MgDouă+ există șase sfere roșii conectate la sferele lor albe respective; adică unitățile octaedrice Mg (OH)6. OH- acționează ca o punte pentru a uni doi MgDouă+ de diferite planuri, ceea ce face ca straturile să fie împletite.
De asemenea, se observă că atomii de hidrogen sunt îndreptați în sus și în jos și sunt în primul rând responsabili de forțele intermoleculare care țin cele două straturi ale unităților Mg (OH) împreună.6.
Moleculele neutre (cum ar fi alcoolii, amoniacul și azotul) sau chiar anionii se pot adăuga între aceste straturi, în funcție de cât de pozitive sunt (dacă există ioni Al3+ o Credință3+ înlocuind MgDouă+). „Umplutura” acestor specii este limitată de suprafețele compuse din anionii OH-.
Morfologii
Sticla dublă, hexagonală, crește încet sau rapid. Totul depinde de parametrii de sinteză sau de preparare: temperatură, raport molar, agitare, solvenți, reactivi ca sursă de magneziu, baze sau agenți de precipitare etc. Pe măsură ce cristalul crește, acesta definește microstructura sau morfologia nanoparticulelor sau agregatelor sale.
Astfel, aceste nanoparticule pot avea morfologii asemănătoare plăcii, trombocitelor sau globulelor. La fel, distribuția dimensiunilor lor se poate modifica, la fel și gradul de porozitate al solidelor rezultate..
Proprietăți
Aspectul fizic
Este un solid alb, granular sau pudrat și inodor.
Masă molară
58,3197 g / mol.
Densitate
3,47 g / ml.
Punct de topire
350 ° C. La această temperatură se descompune în oxid prin eliberarea moleculelor de apă conținute în cristalele sale:
Mg (OH)Două(s) => MgO (s) + HDouăO (g)
Solubilitatea apei
0,004 g / 100 ml la 100 ° C; adică abia se dizolvă în apă clocotită, făcându-l un compus insolubil în apă. Cu toate acestea, pe măsură ce pH-ul scade (sau aciditatea crește), solubilitatea acestuia crește datorită formării complexului apos, Mg (OHDouă)6.
Pe de altă parte, dacă Mg (OH)Două a absorbit CODouă, va elibera gazul reținut ca efervescență atunci când este dizolvat într-un mediu acid.
Indicele de refracție
1.559
pH
O suspensie apoasă a acesteia are un pH care variază între 9,5 și 10,5. Deși aceste valori sunt normale, reflectă basicitatea sa scăzută în comparație cu alți hidroxizi metalici (cum ar fi NaOH).
Capacitate de căldură
77,03 J / mol K
Unde se află?

Hidroxidul de magneziu poate fi găsit în natură sub numele de brucită minerală, care se caracterizează prin culoarea sa albă transparentă, cu tonuri verzi sau albăstrui în funcție de impuritățile sale. De asemenea, brucita face parte din unele argile, cum ar fi cloritul, deoarece este intercalat între straturile de silicați, unite de ioni metalici..
În brucită există și alți ioni pe lângă MgDouă+, ca Al3+, Credinţă3+, ZnDouă+ și MnDouă+. Minereurile sale pot fi găsite în diferite regiuni sau lacuri din Scoția, Canada, Italia și SUA..
Fizic cristalele sale arată ca sticla topită (imaginea superioară), cu culori albe, cenușii, albăstrui sau verzui și transparente în exemplare rare.
Acest mineral este una dintre relele care afectează cimenturile și betonul, deoarece tinde să se extindă și să provoace fracturi în ele. Cu toate acestea, nu absoarbe CODouă, deci calcinarea sa nu contribuie la efectul de seră și, prin urmare, este o sursă mineralogică adecvată (și cea mai bogată) pentru a obține magneziu, pe lângă apa de mare.
Nomenclatură
Mg (OH)Două Are până la trei nume acceptate de IUPAC (în afara mineralogiei sau medicinei). Acestea sunt foarte asemănătoare una cu cealaltă, deoarece modul în care ajung cu greu variază..
De exemplu, „hidroxid de magneziu” corespunde denumirii sale conform nomenclaturii stocului, omițând (II) la sfârșit deoarece +2 este aproape în mod implicit singura stare de oxidare a magneziului.
„Dihidroxid de magneziu”, care indică numărul de ioni OH cu prefixul numărătorului grecesc- indicată în formulă conform nomenclaturii sistematice. Și „hidroxid de magneziu”, care se termină cu sufixul -ico pentru a fi starea de oxidare maximă și „numai” a magneziului, conform nomenclaturii tradiționale..
Celelalte denumiri, cum ar fi brucita sau magnezia din lapte, deși sunt direct legate de acest compus, nu este recomandabil să faceți referire la acesta atunci când vine vorba despre cel mai pur solid sau ca un compus anorganic (reactiv, materie primă etc.).
Aplicații
Neutralizator
Mg (OH)Două Datorită solubilității sale scăzute în apă, este un excelent neutralizator al acidității; în caz contrar, ar fundamenta mediul prin furnizarea de concentrații mari de ioni OH-, la fel ca și alte baze (electroliți puternici).
Astfel, Mg (OH)Două abia eliberează OH-, în timp ce reacționează cu ioni H3SAU+ pentru a forma complexul apos de magneziu, menționat și mai sus. Fiind capabil să neutralizeze aciditatea mediilor apoase, este destinat tratamentului apelor uzate.
Este, de asemenea, un aditiv la alimente, îngrășăminte și la anumite produse de igienă personală, cum ar fi pasta de dinți, deoarece le reduce aciditatea..
Antiacid
Fiind ușor solubil în apă, poate fi ingerat fără a risca efectele ionilor săi OH- (se disociază foarte puțin ca un electrolit slab).
Această caracteristică, legată de subsecțiunea de mai sus, îl face un antiacid pentru tratarea arsurilor la stomac, a bolilor gastrointestinale, a indigestiei și a constipației, vândute sub formula laptelui de magnezie..
Pe de altă parte, laptele de magnezie ajută și la combaterea aftelor deranjante (rănile albe și roșii care apar în gură).
Ignifug
În secțiunea de proprietăți s-a menționat că Mg (OH)Două se descompune eliberând apă. Tocmai, această apă ajută la oprirea avansului flăcărilor, deoarece acestea absorb căldura pentru a se vaporiza și, la rândul lor, vaporii diluează gazele combustibile sau inflamabile.
Mineralul brucită este de obicei utilizat în acest scop industrial, destinat ca material de umplutură în anumite materiale, cum ar fi materialele plastice din diferiți polimeri (PVC, rășini, cauciucuri), cabluri sau tavane..
Catalizator
Mg (OH)Două sintetizat ca nanoplate, s-a dovedit a fi eficient în catalizarea reducerilor chimice; de exemplu, cel al 4-nitrofenolului (Ph-NODouă) la 4-aminofenol (Ph-NHDouă). De asemenea, au activitate antibacteriană, deci ar putea fi folosit ca agent terapeutic..
Adsorbant
Unele solide de Mg (OH)Două pot fi destul de poroși, în funcție de metoda de preparare a acestora. Prin urmare, găsesc aplicația ca adsorbanți.
În soluții apoase pot adsorbi (pe suprafețele lor) moleculele de colorant, clarificând apa. De exemplu, sunt capabili să adsorbă colorantul indigo carmin prezent în curenții de apă..
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Hidroxid de magneziu. Recuperat de pe: en.wikipedia.org
- Centrul Național pentru Informații despre Biotehnologie. (2019). Hidroxid de magneziu. Baza de date PubChem. CID = 14791. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Galeriile Ametistului. (2014). Brucita minerală. Recuperat de pe: galleries.com
- Henrist și colab. (2003). Studiu morfologic al nanoparticulelor de hidroxid de magneziu
- precipitat în soluție apoasă diluată. Journal of Crystal Growth 249, 321-330.
- Saba J., Shanza R. K., Muhammad R. S. (2018). Sinteza și analiza structurală a nanoparticulelor mezoporoase de hidroxid de magneziu ca catalizator eficient.
- Thimmasandra Narayan Ramesh și Vani Pavagada Sreenivasa. (2015). Îndepărtarea colorantului Indigo Carmine din soluția apoasă folosind hidroxid de magneziu ca adsorbant. Jurnalul de materiale, vol. 2015, ID articol 753057, 10 pagini. doi.org/10.1155/2015/753057



Nimeni nu a comentat acest articol încă.