
Caracteristici complete, structură și funcții
integrine sunt un grup mare sau o familie de proteine de suprafață celulară, aparent unice regnului animal. Ele sunt principala resursă a celulelor pentru a menține interacțiunea (sub formă de aderență) cu alte celule și cu matricea celulară.
Structura sa este alcătuită din două subunități numite alfa și beta. La mamifere se știe că există între 16-18 unități alfa și 3-8 beta, care vor acționa în funcție de combinația lor, precum și de starea fiziologică a celulei sau a țesutului specific.
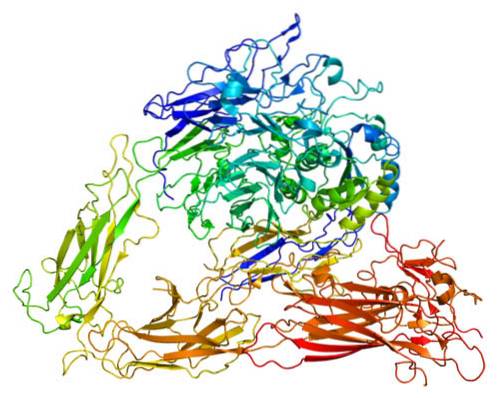
Există mai multe proteine care au funcții adezive. Cu toate acestea, grupul de integrine este cel care este cel mai distribuit și interacționează cu toate proteinele cheie ale matricei celulare. Integrinele participă la fagocitoză, migrația celulară și vindecarea rănilor și sunt chiar foarte studiate pentru participarea lor la metastaze.
Indice articol
- 1 Caracteristici
- 2 Structura
- 2.1 Subunitatea alfa
- 2.2 Subunitatea beta
- 3 Funcții
- 3.1 Atașarea celulelor sau cuplarea la matricea extracelulară
- 3.2 Transducția semnalului de la matricea extracelulară la celulă
- 4 Integrine și cancer
- 5 Perspectiva evolutivă
- 6 Referințe
Caracteristici
Sunt proteine care se caracterizează prin legarea mecanică a citoscheletului celular al unei celule la alta și / sau la matricea extracelulară (într-o interacțiune celulă-celulă și / sau celulă-matrice). Din punct de vedere biochimic, ele detectează dacă a avut loc sau nu aderența și transduc semnale celulare care leagă mediul extracelular de cel intracelular, în ambele direcții..
Acestea funcționează sau funcționează cu alți receptori, cum ar fi imunoglobiline, caderină, selectine și sindecandi. În ceea ce privește liganzii integrinelor, acestea sunt constituite, printre altele, de fibronectină, fibrinogen, colagen și vitronectină..
Legarea lor de liganzii lor se datorează cationilor divalenți extracelulari precum calciu sau magneziu. Utilizarea uneia sau alteia va depinde de integrina specifică.
Integrinele au o formă alungită care se termină într-un cap în formă de glob, care, conform observațiilor microscopiei electronice, proiectează mai mult de 20 de nanometri din bistratul lipidic.
Structura
Sursă: Berkshire Community College Bioscience Image Library [CC0]
Integrinele sunt heterodimeri, adică sunt molecule întotdeauna formate din două proteine. Ambele proteine sunt considerate subunități sau protomeri și sunt diferențiate ca subunități alfa și subunități beta. Ambele subunități sunt legate necovalent. Au o masă moleculară cuprinsă între 90 și 160 kDa.
Numărul de subunități alfa și beta variază între diferite grupuri de organisme din regnul animal. La insecte precum musca fructelor (Drosophyla), de exemplu, există 5 subunități alfa și 2 beta, în timp ce la viermii nematode din gen Caenorhabdita există 2 alfa și un beta.
La mamifere, cercetătorii sugerează că există un număr fix de subunități și combinațiile acestora; cu toate acestea, nu există consens în literatura de specialitate cu privire la acest număr. De exemplu, unii menționează că există 18 subunități alfa, 8 beta și 24 de combinații, în timp ce alții vorbesc despre 16 alfa și 8 beta pentru 22 de combinații.
Fiecare subunitate are următoarea structură.
Subunitate alfa
Subunitatea alfa are o structură cu un domeniu β-helix de șapte foi sau foi care formează capul, un domeniu în coapsă, două domenii ale vițelului, un singur domeniu transmembranar și, de asemenea, o coadă citoplasmatică scurtă care nu prezintă activitate enzimatică sau legarea actinei.
Prezintă lanțuri cu aproximativ 1000 până la 1200 de reziduuri. Poate lega cationii divalenți.
La mamifere, unde au fost studiate cel mai mult integrinele, subunitățile alfa pot fi grupate în funcție de conținerea sau nu a unui domeniu inserat (alfa I).
Cu domeniul inserat Alpha I
Domeniul alfa I inserat constă dintr-o regiune de 200 aminoacizi. Prezența acestui domeniu în integrine indică faptul că sunt receptori pentru colagen și leucocite..
Nu a fost introdus niciun domeniu
Integrinele alfa care nu au domeniul integrat sunt clasificate în 4 subfamilii, pe care le vom vedea mai jos.
PS1
Receptorii glicoproteinelor, numiți și laminine, sunt vitale pentru integrarea țesuturilor musculare, renale și cutanate.
PS2
Această subfamilie este receptorul acidului arginilglicilaspartic, cunoscut și sub denumirea de RGD sau Arg-Gly-Asp..
PS3
Această subfamilie a fost observată la nevertebrate, în special la insecte. Deși se știe puțin despre aceasta, există studii care evaluează rolul său esențial în activitatea funcțională a genei CD11d a integrinei leucocitelor la om..
PS4
Această subfamilie este cunoscută sub numele de grupa alfa 4 / alfa 9 și cuprinde subunitățile cu aceleași nume..
Respectivele subunități sunt capabile să se asocieze cu subunitățile beta 1 și beta 7. De asemenea, au liganzi foarte asemănători cu subunitățile alfa care prezintă domeniul alfa I inserat, cum ar fi moleculele de adeziune a celulelor vasculare, liganzii solubili în sânge, fibrinogenul și altele agenți patogeni.
Subunitate beta
Structural, subunitatea beta constă dintr-un cap, o secțiune numită tulpină / picior, un domeniu transmembranar și o coadă citoplasmatică. Capul este compus dintr-un domeniu beta I, care se inserează într-un domeniu hibrid care se leagă de domeniul plexină-semafor-integrină, cunoscut și sub numele de PSI..
Secțiunea tulpină / picior conține patru module egale sau foarte asemănătoare cu factorul de creștere epidermică integrină bogat în cisteină și, după cum sa menționat deja, o coadă citoplasmatică. Această coadă citoplasmatică, ca și în subunitatea alfa, nu are activitate enzimatică sau de legare a actinei..
Au lanțuri cu un număr de reziduuri cuprinse între 760 și 790 și pot lega, precum subunitățile alfa, cationii bivalenți.
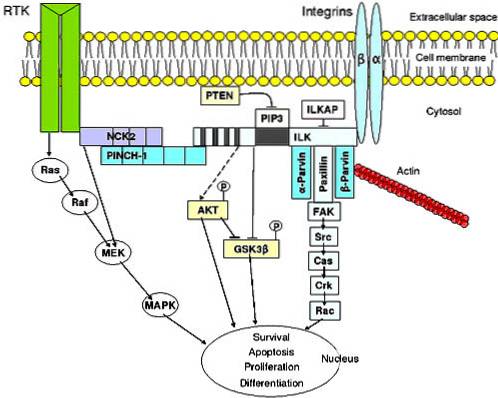
Caracteristici
Integrinele au funcții multiple, totuși pentru care sunt cunoscute în principal sunt cele pe care le vom vedea mai jos.
Atașarea sau cuplarea celulei la matricea extracelulară
Conexiunea care există între celulă și matricea extracelulară grație integrinelor favorizează rezistența celulei la presiunea mecanică, împiedicându-le să fie rupte din matrice.
Mai multe studii sugerează că cuplarea la matricea celulară este o cerință de bază pentru dezvoltarea organismelor eucariote multicelulare..
Migrația celulară este un proces în care integrinele intervin prin legarea sau cuplarea la diferite substraturi. Datorită acestui fapt, ei intervin în răspunsul imun și vindecarea rănilor.
Transducția semnalului de la matricea extracelulară la celulă
Integrinele participă la procesul de transducție a semnalului. Aceasta înseamnă că intervin în recepția informațiilor din fluidul extracelular, le codifică și apoi începe modificarea moleculelor intracelulare, ca răspuns.
Această transducție a semnalului este implicată într-un număr mare de procese fiziologice, cum ar fi distrugerea celulară programată, diferențierea celulară, meioza și mitoza (diviziunea celulară) și creșterea celulară, printre altele..
Integrine și cancer
Mai multe studii arată că integrinele joacă un rol important în dezvoltarea tumorii, în special în metastaze și angiogeneză. Un exemplu în acest sens sunt integrinele αVβ3 și α1β1, printre altele..
Aceste integrine au fost legate de creșterea cancerului, rezistența terapeutică crescută și neoplasmele hematopoietice.
Perspectiva evolutivă
O aderență eficientă între celule pentru a forma țesuturi a fost, fără îndoială, o caracteristică crucială care trebuie să fi fost prezentă în dezvoltarea evolutivă a organismelor multicelulare..
Apariția familiei integrinei a fost urmărită până la apariția metazoanelor în urmă cu aproximativ 600 de milioane de ani..
Un grup de animale cu caracteristici histologice ancestrale sunt poriferele, denumite în mod obișnuit bureți de mare. La aceste animale, aderența celulară are loc printr-o matrice extracelulară de proteoglican. Receptorii care se leagă de această matrice posedă un motiv tipic de legare a integrinei.
De fapt, în acest grup de animale, au fost identificate gene legate de subunități specifice ale unor integrine..
În cursul evoluției, strămoșul metazoanelor a dobândit o integrină și un domeniu de legare la aceasta, care a fost conservat de-a lungul timpului în acest grup imens de animale..
Structural, vedem complexitatea maximă a integrinelor din grupul vertebratelor. Există diferite integrine care nu sunt prezente în nevertebrate, cu domenii noi. Într-adevăr, la om au fost identificate peste 24 de integrine funcționale diferite - în timp ce la muștele fructelor Drosophila melanogaster sunt doar 5.
Referințe
- Integrin. Clinica Universității din Navarra. Recuperat din cun.es.
- Aderare. Atlasul histologiei plantelor și animalelor. Recuperat de la mmegias.webs.uvigo.es.
- B. Alberts, A. Johnson, J. Lewis și colab. (2002). Biologia moleculară a celulei. Ediția a IV-a. New York: Garland Science. Integrine. Recuperat de la ncbi.nlm.nih.gov.
- R.L. Anderson, T.W. Owens & J. Matthew (2014). Funcțiile structurale și mecanice ale integrinelor. Recenzii biofizice.
- Integritate. Recuperat de pe en.wikipedia.org.
- Ce este integrina? MBINFO. Recuperat de la mechanobio.info.
- S. Mac Fhearraigh și D. Bruce. Rolul integrinelor în semnalizarea celulară. Recuperat de pe abcam.com.
- .



Nimeni nu a comentat acest articol încă.