
Formule și unități Charles Law, experiment, exerciții
legea lui Charles sau Guy-Lussac este unul care permite afirmarea uneia dintre proprietățile stării gazoase: volumul pe care îl ocupă un gaz este direct proporțional cu temperatura la presiune constantă.
Această proporționalitate este liniară pentru toate intervalele de temperatură dacă gazul în cauză este ideal; gazele reale, pe de altă parte, se abat de la tendința liniară la temperaturi apropiate de punctul lor de rouă. Cu toate acestea, acest lucru nu a limitat utilizarea acestei legi pentru o multitudine de aplicații care implică gaze..

Una dintre aplicațiile chintesențiale ale legii lui Charles este în baloanele cu aer. Alte baloane mai simple, precum cele ale dorințelor, numite și felinare chinezești (imaginea superioară), dezvăluie relația dintre volum și temperatura unui gaz la presiune constantă.
De ce la presiune constantă? Pentru că dacă presiunea ar crește, ar însemna că recipientul în care se află gazul este închis ermetic; și cu aceasta, coliziunile sau impacturile particulelor gazoase împotriva pereților interni ai containerului menționat ar crește (legea Boyle-Mariotte).
Prin urmare, nu ar exista nicio modificare a volumului ocupat de gaz, iar legea lui Charles ar lipsi. Spre deosebire de un container etanș, țesătura baloanelor de dorințe reprezintă o barieră mobilă, capabilă să se extindă sau să se contracteze în funcție de presiunea exercitată de gazul din interior..
Cu toate acestea, pe măsură ce țesutul baloanelor se extinde, presiunea internă a gazului rămâne constantă, deoarece suprafața peste care se ciocnesc particulele sale crește. Cu cât temperatura gazului este mai mare, cu atât este mai mare energia cinetică a particulelor și, prin urmare, numărul de coliziuni.
Și pe măsură ce balonul se extinde din nou, coliziunile împotriva pereților săi interni rămân (în mod ideal) constante..
Deci, cu cât gazul este mai fierbinte, cu atât expansiunea balonului este mai mare și cu atât va crește. Rezultatul: lumini roșiatice (deși periculoase) suspendate pe cer în nopțile de decembrie..
Indice articol
- 1 Care este legea lui Charles?
- 1.1 Declarație
- 1.2 Locuri de muncă
- 1.3 Grafic
- 2 Formule și unități de măsură
- 2.1 Formule
- 2.2 Unități
- 3 Experimentați pentru a dovedi legea
- 3.1 Montare
- 3.2 Dezvoltare
- 3.3 Balon cu gheață iarna
- 4 exerciții rezolvate
- 4.1 Exercițiul 1
- 4.2 Exercițiul 2
- 4.3 Exercițiul 3
- 5 Aplicații
- 5.1 Baloane de urări
- 5.2 Termometre pop-up sau curcan
- 5.3 Restabilirea formei bilelor de ping-pong
- 5.4 Pregătirea pâinilor
- 6 Referințe
Care este legea lui Charles?
Afirmație
Așa-numita lege a lui Charles sau legea lui Gay-Lussac explică dependența care există între volumul ocupat de un gaz și valoarea temperaturii sale absolute sau a temperaturii Kelvin..
Legea poate fi enunțată după cum urmează: dacă presiunea rămâne constantă, rezultă că „pentru o anumită masă de gaz, își mărește volumul cu aproximativ 1/273 ori volumul său la 0 ° C, pentru fiecare grad centigrad (1 ° C) pentru a-și crește temperatura ".
Locuri de munca
Lucrarea de cercetare care a stabilit legea a fost începută în anii 1780 de Jacques Alexander Cesar Charles (1746-1823). Cu toate acestea, Charles nu a publicat rezultatele cercetărilor sale..
Mai târziu, John Dalton în 1801 a reușit să determine experimental că toate gazele și vaporii, studiați de el, se extind între două temperaturi determinate în aceeași cantitate de volum. Aceste rezultate au fost confirmate de Gay-Lussac în anul 1802.
Lucrările de cercetare ale lui Charles, Dalton și Gay-Lussac au permis stabilirea faptului că volumul ocupat de un gaz și temperatura sa absolută sunt direct proporționale. Prin urmare, există o relație liniară între temperatură și volumul unui gaz.
Grafic
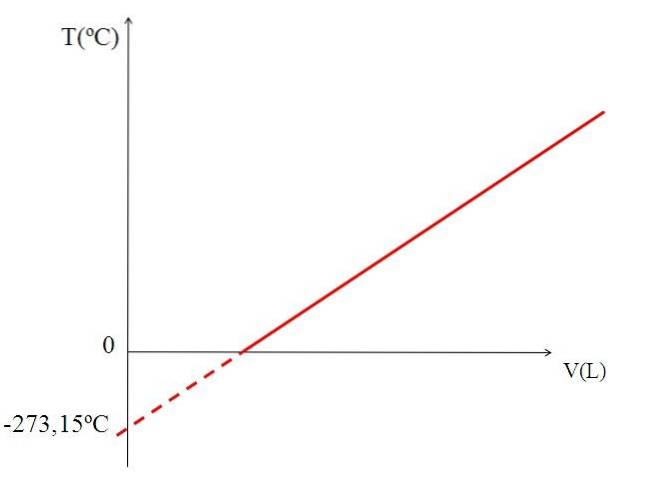
Graficarea (imaginea de sus) a volumului unui gaz comparativ cu temperatura produce o linie dreaptă. Intersecția liniei cu axa X, la o temperatură de 0 ° C, permite obținerea volumului gazului la 0 ° C.
La fel, intersecția liniei cu axa X ar oferi informații despre temperatura pentru care volumul ocupat de gaz ar fi zero „0”. Dalton a estimat această valoare la -266 ºC, aproape de valoarea sugerată de Kelvin pentru zero absolut (0).
Kelvin a propus o scală de temperatură al cărei zero ar trebui să fie temperatura la care un gaz perfect ar avea un volum de zero. Dar la aceste temperaturi scăzute gazele sunt lichefiate.
De aceea nu se poate vorbi de volume de gaze ca atare, constatând că valoarea pentru zero absolut ar trebui să fie -273,15 ºC.
Formule și unități de măsură
Formule
Legea lui Charles, în versiunea sa modernă, afirmă că volumul și temperatura unui gaz sunt direct proporționale.
Atunci:
V / T = k
V = volumul de gaz. T = temperatura Kelvin (K). k = constanta de proportionalitate.
Pentru un volum V1 și o temperatură T1
k = V1 / T1
La fel, pentru un volum V.Două și o temperatură TDouă
k = VDouă / TDouă
Apoi, echivalând cele două ecuații pentru k pe care le avem
V1 / T1 = VDouă / TDouă
Această formulă poate fi scrisă după cum urmează:
V1 TDouă = VDouă T1
Rezolvarea pentru VDouă, veți obține formula:
VDouă = V1 TDouă / T1
Unități
Volumul gazului poate fi exprimat în litri sau în oricare dintre unitățile sale derivate. La fel, volumul poate fi exprimat în metri cubi sau în orice unitate derivată. Temperatura trebuie exprimată în temperatură absolută sau temperatură Kelvin.
Deci, dacă temperaturile unui gaz sunt exprimate în grade centigrade sau scara Celsius, pentru a efectua un calcul cu acestea, cantitatea de 273,15 ºC ar trebui adăugată la temperaturi, pentru a le aduce la temperaturi absolute sau kelvin..
Dacă temperaturile sunt exprimate în grade Fahrenheit, ar fi necesar să adăugați 459,67 ºR la aceste temperaturi, pentru a le aduce la temperaturi absolute pe scara Rankine..
O altă formulă binecunoscută a Legii lui Charles și direct legată de afirmația sa este următoarea:
Vt = Vsau (1 + t / 273)
Unde Vt este volumul ocupat de un gaz la o anumită temperatură, exprimat în litri, cm3, etc .; și Vsau este volumul ocupat de un gaz la 0 ° C. La rândul său, t este temperatura la care se măsoară volumul, exprimată în grade centigrade (ºC).
Și, în cele din urmă, 273 reprezintă valoarea zero absolut pe scara de temperatură Kelvin.
Experimentați pentru a dovedi legea
Montare
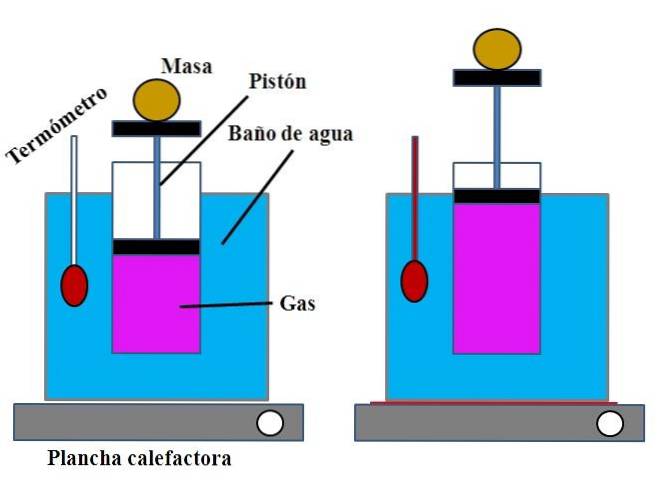
Într-un recipient cu apă, care îndeplinea funcția de baie de apă, un cilindru deschis a fost plasat în partea de sus, cu un piston care se potrivea pe peretele interior al cilindrului (imaginea superioară).
Acest piston (format din piston și cele două baze negre) s-ar putea deplasa spre partea superioară sau inferioară a cilindrului în funcție de volumul de gaz pe care îl conținea..
Baia de apă poate fi încălzită folosind un arzător sau o instalație de încălzire, care furniza căldura necesară pentru a crește temperatura băii și, prin urmare, temperatura cilindrului echipat cu un piston..
O masă determinată a fost plasată pe piston pentru a se asigura că experimentul a fost efectuat la presiune constantă. Temperatura băii și a cilindrului a fost măsurată folosind un termometru plasat în baia de apă..
Deși probabil cilindrul nu a avut o gradare pentru a vizualiza volumul de aer, acest lucru ar putea fi estimat prin măsurarea înălțimii atinse de masa plasată pe piston și suprafața bazei cilindrului..
în curs de dezvoltare
Volumul unui cilindru se obține prin înmulțirea suprafeței bazei sale cu înălțimea sa. Suprafața bazei cilindrului ar putea fi obținută prin aplicarea formulei: S = Pi x rDouă.
În timp ce înălțimea este obținută prin măsurarea distanței de la baza cilindrului, până la partea pistonului pe care se sprijină masa.
Deoarece temperatura băii a fost crescută de căldura produsă de brichetă, sa observat că pistonul crește în interiorul cilindrului. Apoi, au citit pe termometru temperatura din baia de apă, care a corespuns temperaturii din interiorul cilindrului..
La fel, au măsurat înălțimea masei deasupra pistonului, putând estima volumul de aer care corespundea temperaturii măsurate. În acest fel, au făcut mai multe măsurători ale temperaturii și estimări ale volumului de aer corespunzător fiecărei temperaturi..
Cu aceasta, a fost în cele din urmă posibil să se stabilească faptul că volumul pe care îl ocupă un gaz este direct proporțional cu temperatura acestuia. Această concluzie a permis enunțarea așa-numitei Lege a lui Carol.
Balon cu gheață iarna
Pe lângă experimentul anterior, există unul mai simplu și mai calitativ: cel al balonului cu gheață în timpul iernii..
Dacă un balon umplut cu heliu ar fi plasat într-o cameră încălzită iarna, balonul ar avea un anumit volum; Dar, dacă mai târziu ar fi mutat în exteriorul casei cu o temperatură scăzută, s-ar observa că balonul de heliu se micșorează, reducându-și volumul conform Legii lui Charles.
Exerciții rezolvate
Exercitiul 1
Există un gaz care ocupă un volum de 750 cm3 la 25 ° C: care va fi volumul pe care acest gaz îl ocupă la 37 ° C dacă presiunea este menținută constantă?
Este necesar mai întâi să transformați unitățile de temperatură în kelvin:
T1 în grade Kelvin = 25 ºC + 273,15 ºC = 298,15 K
TDouă în grade Kelvin = 37 ºC + 273,15 ºC = 310,15 K
Pentru că V1 și celelalte variabile, le rezolvăm pentru VDouă și se calculează cu următoarea ecuație:
VDouă = V1 · (TDouă / T1)
= 750 cm3 · (310,15 K / 298,15 K)
= 780,86 cm3
Exercițiul 2
Care ar fi temperatura în grade Celsius la care 3 litri de gaz ar trebui încălziți la 32 ° C, astfel încât volumul său să se extindă la 3,2 litri?
Din nou, gradele centigrade sunt transformate în kelvin:
T1 = 32 ºC + 273,15 ºC = 305,15 K
Și, ca și în exercițiul anterior, T este eliminatDouă în loc de VDouă, și se calculează mai jos:
TDouă = VDouă · (T1 / V1)
= 3,2 L · (305,15 K / 3 L)
= 325,49 K
Dar declarația cere grade Celsius, deci unitatea T este schimbatăDouă:
TDouă în grade centigrade = 325, 49 ºC (K) - 273,15 ºC (K)
= 52,34 ºC
Exercițiul 3
Dacă un gaz la 0 ° C ocupă un volum de 50 cm3, Ce volum va ocupa la 45 ° C?
Folosind formula originală a legii lui Charles:
Vt = Vsau (1 + t / 273)
Continuăm să calculăm Vt direct, deoarece toate variabilele sunt disponibile:
Vt = 50 cm3 + 50 cm3 · (45 ºC / 273 ºC (K))
= 58,24 cm3
Pe de altă parte, dacă problema este rezolvată folosind strategia exemplelor 1 și 2, vom avea:
VDouă = V1 · (TDouă / T1)
= 318 K · (50 cm3 / 273 K)
= 58,24 cm3
Rezultatul, aplicând cele două proceduri, este același, deoarece în cele din urmă se bazează pe același principiu al legii lui Charles.
Aplicații
Doresc baloane
Baloanele dorite (menționate deja în introducere) sunt echipate cu un material textil impregnat cu un lichid combustibil.
Atunci când acest material este incendiat, există o creștere a temperaturii aerului conținut în balon, ceea ce determină o creștere a volumului de gaz conform legii lui Charles..
Prin urmare, prin creșterea volumului de aer din balon, densitatea aerului din acesta scade, care devine mai mică decât densitatea aerului înconjurător și de aceea balonul crește.
Termometre pop-up sau curcan
După cum indică și numele lor, acestea sunt folosite în timpul gătitului curcanilor. Termometrul are un recipient umplut cu aer închis cu un capac și este calibrat în așa fel încât, atunci când se atinge temperatura optimă de gătire, capacul să fie ridicat emițând un sunet..
Termometrul este plasat în interiorul curcanului și, pe măsură ce temperatura din interiorul cuptorului crește, aerul din interiorul termometrului se extinde, mărind volumul acestuia. Apoi, când volumul de aer atinge o anumită valoare, ridicați capacul termometrului.
Restabilirea formei bilelor de ping-pong
În funcție de cerințele de utilizare a acestora, bilele de ping-pong au o greutate redusă, iar pereții lor din plastic sunt subțiri. Acest lucru face ca atunci când sunt afectate de rachete să sufere deformări.
Prin plasarea bilelor deformate în apă fierbinte, aerul din interior se încălzește și se extinde, ducând la o creștere a volumului de aer. Acest lucru face ca peretele bilelor de ping-pong să se întindă, permițându-le să revină la forma lor originală..
Fabricarea pâinii
Drojdiile sunt încorporate în făina de grâu folosită la fabricarea pâinii și au capacitatea de a produce dioxid de carbon gazos..
Pe măsură ce temperatura pâinilor crește în timpul gătitului, volumul de dioxid de carbon crește. Din această cauză pâinea se extinde până ajunge la volumul dorit..
Referințe
- Clark J. (2013). Alte legi privind gazele - Legea lui Boyle și Legea lui Charles. Recuperat de pe: chemguide.co.uk
- Staroscik Andrew. (2018). Legea lui Charles. Recuperat de pe: scienceprimer.com
- Wikipedia. (2019). Charles Law. Recuperat de pe: en.wikipedia.org
- Helmenstine, Todd. (27 decembrie 2018). Care este formula legii lui Charles? Recuperat de pe: thoughtco.com
- Prof. N. De Leon. (s.f.). Legile elementare ale gazelor: Charles Law. Note de clasă C 101. Recuperat de la: iun.edu
- Briceño Gabriela. (2018). Charles Law. Recuperat de pe: euston96.com
- Morris, J. G. (1974). Fizico-chimie pentru biologi. (Douădă ediție). Editorial Reverté, S.A.



Nimeni nu a comentat acest articol încă.