
Ecuația legii lui Henry, abaterea, aplicații
legea lui Henry afirmă că la o temperatură constantă, cantitatea de gaz dizolvată într-un lichid este direct proporțională cu presiunea sa parțială pe suprafața lichidului.
A fost postulat în 1803 de către fizicianul și chimistul englez William Henry. Legea sa poate fi interpretată și în acest fel: dacă presiunea asupra lichidului crește, cu atât va fi mai mare cantitatea de gaz dizolvată în el..

Aici gazul este considerat ca soluția soluției. Spre deosebire de solutul solid, temperatura are un efect negativ asupra solubilității sale. Astfel, pe măsură ce temperatura crește, gazul tinde să scape din lichid mai ușor spre suprafață..
Acest lucru se datorează faptului că creșterea temperaturii contribuie cu energie la moleculele gazoase, care se ciocnesc între ele pentru a forma bule (imaginea de sus). Aceste bule depășesc apoi presiunea externă și scapă din sinusul lichidului..
Dacă presiunea externă este foarte ridicată și lichidul este menținut la rece, bulele se vor dizolva și doar câteva molecule gazoase vor „flutura” la suprafață.
Indice articol
- 1 Ecuația legii lui Henry
- 2 Abatere
- 3 Solubilitatea unui gaz în lichid
- 3.1 Nesaturat
- 3.2 Saturat
- 3.3 suprasaturat
- 4 Aplicații
- 5 Exemple
- 6 Referințe
Ecuația legii lui Henry
Poate fi exprimat prin următoarea ecuație:
P = KH∙ C
Unde P este presiunea parțială a gazului dizolvat; C este concentrația gazului; și KH este constanta lui Henry.
Este necesar să înțelegem că presiunea parțială a unui gaz este aceea care este exercitată individual de o specie din restul amestecului total de gaze. Și presiunea totală nu este altceva decât suma tuturor presiunilor parțiale (Legea lui Dalton):
PTotal= P1 + PDouă + P3+… + Pn
Numărul de specii gazoase care alcătuiesc amestecul este reprezentat de n. De exemplu, dacă pe suprafața unui lichid există vapori de apă și CODouă, n este egal cu 2.
Deviere
Pentru gazele slab solubile în lichide, soluția este aproape de ideal, respectând legea lui Henry pentru solut.
Cu toate acestea, atunci când presiunea este mare, există o abatere față de Henry, deoarece soluția încetează să se comporte ca un diluat ideal.
Ce înseamnă? Că interacțiunile solut-solut și solut-solvent încep să aibă propriile lor efecte. Când soluția este foarte diluată, moleculele de gaz sunt „exclusiv” înconjurate de solvent, neglijând posibilele întâlniri între ele..
Prin urmare, atunci când soluția nu mai este diluată în mod ideal, pierderea comportamentului liniar este observată în graficul Peu vs Xeu.
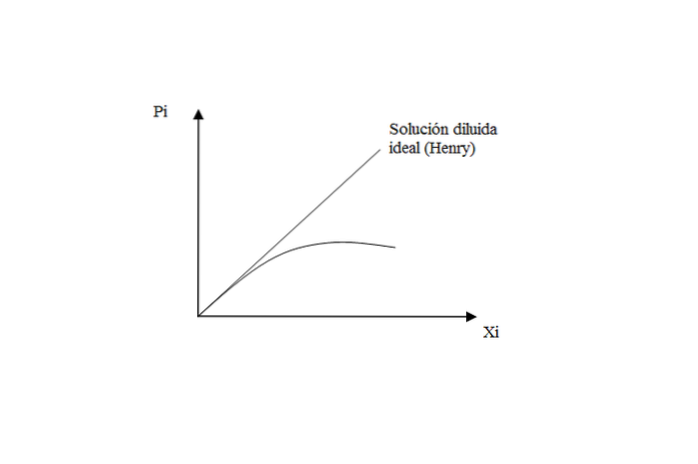
În concluzie la acest aspect: legea lui Henry determină presiunea de vapori a unui dizolvat într-o soluție diluată ideală. În timp ce pentru solvent, se aplică legea lui Raoult:
PLA = XLA∙ PLA*
Solubilitatea unui gaz în lichid

Atunci când un gaz este bine dizolvat într-un lichid, cum ar fi zahărul din apă, nu poate fi distins de mediu, formând astfel o soluție omogenă. Cu alte cuvinte: nu se observă bule în lichid (sau cristale de zahăr).
Cu toate acestea, solvatarea eficientă a moleculelor gazoase depinde de unele variabile precum: temperatura lichidului, presiunea care îl afectează și natura chimică a acestor molecule în comparație cu cele ale lichidului..
Dacă presiunea externă este prea mare, șansele ca gazul să pătrundă pe suprafața lichidului sunt crescute. Și, pe de altă parte, moleculelor gazoase dizolvate le este mai greu să depășească presiunea incidentă pentru a scăpa în exterior..
Dacă sistemul de gaz lichid este sub agitare (așa cum se întâmplă în mare și în pompele de aer din rezervorul de pește), absorbția gazului este favorizată.
Și cum afectează natura solventului absorbția unui gaz? Dacă este polar, ca și apa, va arăta afinitate pentru solutii polari, adică pentru acele gaze care au un moment dipol permanent. În timp ce, dacă este apolar, cum ar fi hidrocarburile sau grăsimile, va prefera moleculele gazoase apolare
De exemplu, amoniacul (NH3) este un gaz foarte solubil în apă datorită interacțiunilor de legare a hidrogenului. În timp ce hidrogenul (HDouă), a cărei moleculă mică este apolară, interacționează slab cu apa.
De asemenea, în funcție de starea procesului de absorbție a gazului în lichid, în acestea pot fi stabilite următoarele stări:
Nesaturat
Lichidul este nesaturat atunci când este capabil să dizolve mai mult gaz. Acest lucru se datorează faptului că presiunea externă este mai mare decât presiunea internă a lichidului..
Saturați
Lichidul stabilește un echilibru în solubilitatea gazului, ceea ce înseamnă că gazul scapă în același ritm în care pătrunde în lichid..
Poate fi văzut și în felul următor: dacă trei molecule gazoase scapă în aer, alte trei se vor întoarce în lichid în același timp.
Suprasaturat
Lichidul este suprasaturat cu gaz atunci când presiunea sa internă este mai mare decât presiunea externă. Și, cu o modificare minimă a sistemului, va elibera excesul de gaz dizolvat până la restabilirea echilibrului.
Aplicații
- Legea lui Henry poate fi aplicată pentru a face calculele de absorbție a gazelor inerte (azot, heliu, argon etc.) în diferitele țesuturi ale corpului uman și că, împreună cu teoria lui Haldane, stau la baza tabelelor de decompresie..
- O aplicație importantă este saturația gazelor din sânge. Când sângele este nesaturat, gazul se dizolvă în el, până când devine saturat și încetează să se mai dizolve. Odată ce acest lucru se întâmplă, gazul dizolvat în sânge trece în aer..
- Gazificarea băuturilor răcoritoare este un exemplu de lege aplicată a lui Henry. Băuturile răcoritoare au CODouă dizolvat sub presiune ridicată, menținând astfel fiecare dintre componentele combinate care îl compun; și, în plus, păstrează aroma caracteristică mult mai mult timp.
Când sticla de sodă este decapotată, presiunea de deasupra lichidului scade, eliberând presiunea instantaneu.
Deoarece presiunea asupra lichidului este acum mai mică, solubilitatea CODouă coboară și scapă în mediu (poate fi văzut în creșterea bulelor de jos).

- Pe măsură ce scafandrul coboară la adâncimi mai mari, azotul inhalat nu poate scăpa deoarece presiunea externă îl împiedică, dizolvându-se în sângele individului.
Când scafandrul se ridică rapid la suprafață, unde presiunea externă scade din nou, azotul începe să bule în sânge..
Acest lucru provoacă ceea ce este cunoscut sub numele de boală de decompresie. Din acest motiv, scafandrii trebuie să urce încet, astfel încât azotul să scape mai încet din sânge..
- Studiul efectelor scăderii oxigenului molecular (ODouă) dizolvat în sângele și țesuturile alpiniștilor sau practicienilor de activități care implică ședere prelungită la altitudini mari, precum și în locuitorii din locuri destul de înalte.
- Cercetarea și îmbunătățirea metodelor utilizate pentru a evita dezastrele naturale care pot fi cauzate de prezența gazelor dizolvate în corpuri uriașe de apă care pot fi eliberate violent.
Exemple
Legea lui Henry se aplică numai atunci când moleculele sunt în echilibru. Aici sunt cateva exemple:
- În oxigenul dizolvat (ODouă) în fluidul sanguin, această moleculă este considerată slab solubilă în apă, deși solubilitatea sa este mult crescută de conținutul ridicat de hemoglobină din ea. Astfel, fiecare moleculă de hemoglobină se poate lega de patru molecule de oxigen care sunt eliberate în țesuturi pentru a fi utilizate în metabolism.
- În 1986, a fost înregistrat un nor gros de dioxid de carbon care a fost expulzat brusc din lacul Nyos (situat în Camerun), sufocând aproximativ 1700 de persoane și un număr mare de animale, ceea ce a fost explicat prin această lege.
- Solubilitatea pe care o manifestă un gaz dat la o specie lichidă tinde să crească odată cu creșterea presiunii gazului menționat, deși la presiuni ridicate există anumite excepții, cum ar fi moleculele de azot (NDouă).
- Legea lui Henry nu se aplică atunci când există o reacție chimică între substanța care acționează ca un dizolvat și cea care acționează ca un solvent; acesta este cazul electroliților, cum ar fi acidul clorhidric (HCl).
Referințe
- Crockford, H.D., cavalerul Samuel B. (1974). Bazele fizico-chimiei. (Ed. A 6-a). Editorial C.E.C.S.A., Mexic. P 111-119.
- Redactorii Enciclopediei Britanice. (2018). Legea lui Henry. Adus pe 10 mai 2018, de pe: britannica.com
- Byju's. (2018). Care este legea lui Henry? Adus pe 10 mai 2018, de pe: byjus.com
- Leisurepro & Aquaviews. (2018). Legea lui Henry Adus pe 10 mai 2018, de pe: Leisurepro.com
- Fundația Annenberg. (2017). Secțiunea 7: Legea lui Henry. Adus pe 10 mai 2018, de pe: learner.org
- Monica Gonzalez. (25 aprilie 2011). Legea lui Henry. Adus pe 10 mai 2018, de pe: quimica.laguia2000.com
- Ian Myles. (24 iulie 2009). Scafandru. [Figura]. Adus pe 10 mai 2018, de pe: flickr.com



Nimeni nu a comentat acest articol încă.