
Top 6 factori care afectează solubilitatea
Principal factori care afectează solubilitatea Acestea sunt polaritatea, efectul ionic comun, temperatura, presiunea, natura solutului și factorii mecanici. Solubilitatea este capacitatea unei substanțe chimice solide, lichide sau gazoase (numită substanță dizolvată) de a se dizolva într-un solvent (de obicei un lichid) și de a forma o soluție..
Solubilitatea unei substanțe depinde în principal de solventul utilizat, precum și de temperatură și presiune. Solubilitatea unei substanțe într-un anumit solvent se măsoară prin concentrația soluției saturate.

O soluție este considerată saturată atunci când adăugarea de substanță dizolvată suplimentară nu mai mărește concentrația soluției..
Gradul de solubilitate variază foarte mult în funcție de substanțe, de la infinit solubil (complet miscibil), cum ar fi etanolul în apă, până la ușor solubil, cum ar fi clorura de argint în apă. Termenul "insolubil" este adesea aplicat compușilor slab solubili (Boundless, S.F.).
Anumite substanțe sunt solubile în toate proporțiile cu un anumit solvent, cum ar fi etanolul în apă, această proprietate este cunoscută sub numele de miscibilitate.
În diferite condiții, solubilitatea de echilibru poate fi depășită pentru a da o așa-numită soluție suprasaturată (Solubilitate, S.F.).
Principalii factori care afectează solubilitatea
1- Polaritate
În majoritatea cazurilor, substanțele dizolvate se dizolvă în solvenți care au o polaritate similară. Chimiștii folosesc un aforism popular pentru a descrie această caracteristică a substanțelor dizolvate și a solvenților: „cum se dizolvă ca”.
Solutele nepolare nu se dizolvă în solvenți polari și invers (Educating online, S.F.).
2- Efectul ionului comun
Efectul ionic comun este un termen care descrie scăderea solubilității unui compus ionic atunci când la amestec se adaugă o sare care conține un ion care există deja în echilibru chimic..
Acest efect este cel mai bine explicat de principiul lui Le Châtelier. Imaginați-vă dacă compusul ionic ușor solubil sulfat de calciu, CaSO4, se adaugă în apă. Ecuația ionică netă pentru echilibrul chimic rezultat este după cum urmează:
CaSO4 (s) ⇌Ca2 + (aq) + SO42− (aq)
Sulfatul de calciu este ușor solubil. La echilibru, cea mai mare parte a calciului și a sulfatului există sub forma solidă a sulfatului de calciu..
Să presupunem că compusul ionic solubil sulfat de cupru (CuSO4) a fost adăugat la soluție. Sulfatul de cupru este solubil; Prin urmare, singurul său efect major asupra ecuației ionice nete este adăugarea mai multor ioni sulfat (SO4Două-).
CuSO4 (s) ⇌Cu2 + (aq) + SO42− (aq)
Ionii de sulfat disociați de sulfatul de cupru sunt deja prezenți (obișnuiți) în amestec de la ușa disociere a sulfatului de calciu.
Prin urmare, această adăugare de ioni sulfat subliniază echilibrul stabilit anterior.
Principiul lui Le Chatelier dictează că stresul suplimentar pe această parte a produsului de echilibru are ca rezultat deplasarea echilibrului către partea reactanților pentru a ameliora acest nou stres..
Datorită deplasării către partea reactantă, solubilitatea sulfatului de calciu ușor solubil este redusă în continuare (Erica Tran, 2016).
3- Temperatura
Temperatura are un efect direct asupra solubilității. Pentru majoritatea solidelor ionice, creșterea temperaturii crește cât de repede poate fi realizată soluția.
Pe măsură ce temperatura crește, particulele solidului se mișcă mai repede, ceea ce crește șansele ca acestea să interacționeze cu mai multe particule de solvent. Aceasta are ca rezultat o creștere a vitezei cu care se produce o soluție..
Temperatura poate crește, de asemenea, cantitatea de substanță dizolvată care poate fi dizolvată într-un solvent. În general vorbind, pe măsură ce temperatura crește, se dizolvă mai multe particule dizolvate.
De exemplu, adăugarea zahărului de masă în apă este o metodă ușoară de a face o soluție. Când această soluție este încălzită și se adaugă zahăr, se constată că pot fi adăugate cantități mari de zahăr pe măsură ce temperatura continuă să crească..
Motivul pentru aceasta este că odată cu creșterea temperaturii, forțele intermoleculare se pot sparge mai ușor, permițând atragerea de particule solutate către particulele solventului..
Există însă și alte exemple în care creșterea temperaturii are un efect foarte mic asupra cantității de dizolvat care poate fi dizolvat..
Sarea de masă este un bun exemplu: puteți dizolva aproape aceeași cantitate de sare de masă în apă cu gheață ca în apă clocotită..
Pentru toate gazele, odată cu creșterea temperaturii, solubilitatea scade. Teoria moleculară cinetică poate fi utilizată pentru a explica acest fenomen..
Pe măsură ce temperatura crește, moleculele de gaz se mișcă mai repede și sunt capabile să scape din lichid. Solubilitatea gazului, apoi, scade.
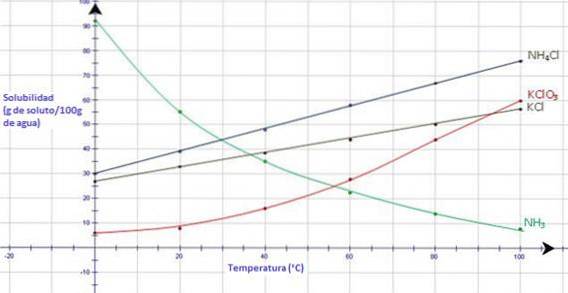
Privind graficul de mai jos, gazul amoniacal, NH3, arată o scădere puternică a solubilității pe măsură ce temperatura crește, în timp ce toate solidele ionice prezintă o creștere a solubilității pe măsură ce temperatura crește (Fundația CK-12, S.F.).
4- Presiune
Al doilea factor, presiunea, afectează solubilitatea unui gaz într-un lichid, dar niciodată a unui solid care se dizolvă într-un lichid..
Când se aplică presiune pe un gaz aflat deasupra suprafeței unui solvent, gazul se va deplasa în solvent și va ocupa o parte din spațiile dintre particulele de solvent..
Un bun exemplu este soda carbogazoasă. Presiunea este aplicată pentru a forța moleculele de CO2 în sodă. Opusul este, de asemenea, adevărat. Când presiunea gazului scade, solubilitatea gazului respectiv scade, de asemenea.
Când se deschide o cutie de sodiu, presiunea din sodă scade, astfel încât gazul începe imediat să iasă din soluție.
Dioxidul de carbon stocat în sodă este eliberat și puteți vedea scânteierea pe suprafața lichidului. Dacă lăsați o cutie de sodă deschisă pentru o perioadă de timp, puteți observa că băutura devine plată din cauza pierderii de dioxid de carbon.
Acest factor de presiune a gazului este exprimat în legea lui Henry. Legea lui Henry afirmă că, la o anumită temperatură, solubilitatea unui gaz într-un lichid este proporțională cu presiunea parțială a gazului de deasupra lichidului.
Un exemplu al legii lui Henry apare în scufundări. Când o persoană se scufundă în apă adâncă, presiunea crește și mai multe gaze se dizolvă în sânge.
În timp ce se ridică dintr-o scufundare în apă adâncă, scafandrul trebuie să se întoarcă la suprafața apei cu o viteză foarte mică pentru a permite tuturor gazelor dizolvate să părăsească sângele foarte încet.
Dacă o persoană urcă prea repede, poate apărea o urgență medicală din cauza gazelor care părăsesc sângele prea repede (Papapodcasts, 2010).
5- Natura solutului
Natura solutului și solventului și prezența altor compuși chimici în soluție afectează solubilitatea..
De exemplu, mai mult zahăr poate fi dizolvat în apă decât sare în apă. În acest caz se spune că zahărul este mai solubil.
Etanolul din apă este complet solubil unul cu celălalt. În acest caz particular, solventul va fi compusul găsit în cea mai mare cantitate.
Mărimea solutului este, de asemenea, un factor important. Cu cât moleculele de solut sunt mai mari, cu atât este mai mare greutatea și dimensiunea moleculară. Este mai dificil pentru moleculele de solvent să înconjoare molecule mai mari.
Dacă toți factorii menționați mai sus sunt excluși, se poate găsi o regulă generală că particulele mai mari sunt în general mai puțin solubile..
Dacă presiunea și temperatura sunt aceleași ca între două substanțe dizolvate de aceeași polaritate, cel cu particule mai mici este de obicei mai solubil (Factori care afectează solubilitatea, S.F.).
6- factori mecanici
Spre deosebire de viteza de dizolvare, care depinde în principal de temperatură, rata de recristalizare depinde de concentrația solutului de pe suprafața rețelei de cristal, care este favorizată atunci când o soluție este imobilă..
Prin urmare, agitarea soluției previne această acumulare, maximizând dizolvarea. (tipuri de saturație, 2014).
Referințe
- (S.F.). Solubilitate. Recuperat de la boundles.com.
- Fundația CK-12. (S.F.). Factori care afectează solubilitatea. Recuperat de la ck12.org.
- Educarea online. (S.F.). Factori care afectează solubilitatea. Recuperat de la solubilityofthings.com.
- Erica Tran, D. L. (2016, 28 noiembrie). Solubilitatea și factorii care afectează solubilitatea. Recuperat de la chem.libretexts.org.
- Factori care afectează solubilitatea. (S.F.). Recuperat de la sciencesource.pearsoncanada.ca.
- (2010, 1 martie). Factorii care afectează solubilitatea Partea 4. Recuperat de pe youtube.com.
- Solubilitate. (S.F.). Recuperat de la chemed.chem.purdue.ed.
- tipuri de saturație. (2014, 26 iunie). Recuperat din chimrete libretex.org.



Nimeni nu a comentat acest articol încă.