
Fundație, preparare și utilizări MIO medii
jumătate MIO este un test biochimic folosit pentru a ajuta la identificarea speciilor de bacterii aparținând familiei Enterobacteriaceae. Este destul de hrănitor și este compus din glucoză, extract de drojdie, peptonă, tripteină, clorhidrat de L-ornitină, bromocrezol purpuriu și agar.
Semnificația acronimului său (MIO) descrie fiecare dintre parametrii care pot fi observați în acest mediu; motilitate, indol și ornitină. Motilitatea este capacitatea microorganismului de a se deplasa datorită prezenței flagelilor. Pentru ca această proprietate să fie respectată, consistența mediului trebuie să fie semi-solidă, astfel încât preparatul conține mai puțin agar..
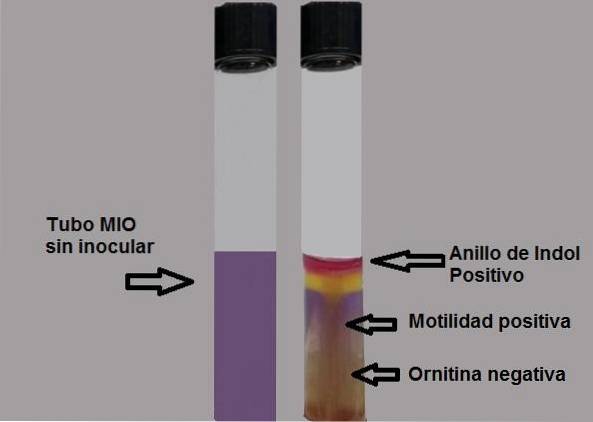
Producția de indol arată prezența enzimei triptofanază care acționează asupra aminoacidului triptofan, necesitând utilizarea unui reactiv revelator pentru a face vizibilă producția de indol..
În cele din urmă, ornitina determină dacă bacteria este capabilă să decarboxileze aminoacidul, adică dacă are enzima orinitină decarboxilază.
Indice articol
- 1 Justificare
- 1.1 Peptonă, extract de drojdie și tripteină
- 1.2 Motilitate
- 1.3 Glucoza
- 1.4 L-Ornitină
- 1,5 indicator pH
- 2 Tehnică de însămânțare și dezvoltare
- 3 Pregătirea
- 3.1 mediu MIO
- 3.2 Reactivul Kovacs (dezvoltator de test Indole)
- 4 Utilizați
- 5 Controlul calității
- 6 Referințe
Bază
Peptonă, extract de drojdie și tripteină
Aceste elemente contribuie la puterea nutrițională a acestui mediu. Acestea servesc ca sursă de nutrienți și aminoacizi esențiali pentru dezvoltarea bacteriilor.
În plus, tripteina este o sursă de triptofan pentru a demonstra prezența enzimei triptofanază, care degradează triptofanul prin dezaminare reductivă, eliberând indol, acid piruvic, amoniac și energie..
Indolul este incolor, prin urmare prezența sa este dezvăluită prin adăugarea a cinci picături de reactiv Ehrlich sau Kovacs, ambele cu p-dimetilaminobenzaldehidă..
Gruparea aldehidă a acestui compus reacționează cu indolul, generând un produs în formă de inel, roșu fucsia pe suprafața agarului..
Orice urmă de culoare trebuie considerată un test pozitiv. Dovada trebuie citită imediat, deoarece în timp culoarea se degradează.
Mai mult, acest test ar trebui să fie dezvăluit după ce au fost observate rezultatele motilității și decarboxilării ornitinei..
Interpretare
Test pozitiv: formarea unui inel roșu fuchsia la adăugarea de picături de reactiv Kovacs.
Test negativ: fără formarea inelului.
Motilitate
Capacitatea bacteriilor de a se mișca va fi evidențiată dacă se observă un mediu tulbure sau dacă există o linie de creștere groasă care se extinde în jurul inoculării inițiale..
Un test de motilitate negativ va fi evidențiat prin observarea unei linii subțiri de creștere, iar tot ceea ce îl înconjoară va fi fără creștere..
Este important ca motilitatea să fie citită înainte de dezvăluirea indolului, deoarece adăugarea reactivului înnorează întregul mediu..
La bacteriile mobile, dar cu creștere lentă, este dificil să-și demonstreze motilitatea cu acest mediu. În acest caz, se recomandă utilizarea altor teste sau metode, cum ar fi motilitatea medie sau metoda în așteptare..
Glucoză
Glucoza este carbohidratul fermentabil care, pe lângă furnizarea de energie, acidifică mediul înconjurător, o condiție necesară pentru decarboxilarea aminoacidului ornitină..
Fermentarea glucozei trebuie să aibă loc întotdeauna, pornind de la principiul conform căruia toate bacteriile aparținând familiei Enterobacteriaceae fermentează glucoza..
L-Ornitină
În cazul în care bacteriile produc enzima ornitină decarboxilază, aceasta poate acționa odată ce mediul a fost acidificat prin fermentarea glucozei..
Enzima ornitină decarboxilază acționează asupra grupului carboxil al aminoacidului producând o amină numită putresină care alcalinizează mediul din nou.
Acest test trebuie citit după 24 de ore de incubație, deoarece dacă încercați să citiți înainte puteți interpreta greșit testul cu un fals negativ.
Trebuie amintit că prima reacție care apare este fermentarea glucozei, motiv pentru care mediul devine galben într-o fază inițială (primele 10 până la 12 ore). Dacă ulterior apare decarboxilarea ornitinei, mediul va deveni violet.
Este important să se interpreteze testul de decarboxilare a ornitinei înainte de a dezvălui indol, deoarece adăugarea reactivului Kovacs modifică culoarea mediului..
Interpretare
Test negativ: fundal galben mediu sau galben.
Test pozitiv: pe jumătate complet violet.
Indicator PH
În acest caz, se folosește bromocrezol purpuriu; cel însărcinat cu dezvăluirea atunci când există o modificare a pH-ului în mediu. Când este acidificat, indicatorul devine galben, iar când este alcalinizat, devine violet.
Tehnică de însămânțare și dezvoltare
Pentru a semăna mediul MIO, se folosește o buclă dreaptă sau un ac și cu acesta se colectează o porțiune din colonie care urmează să fie studiată..
O puncție profundă se face în mijlocul MIO în linie dreaptă. Nu este recomandabil să efectuați o puncție dublă, deoarece poate da o imagine falsă a motilității dacă puncțiile nu sunt efectuate în același loc.
Se incubează timp de 24 până la 48 de ore la 37 ° C în aerobioză. Observați rezultatele în această ordine: motilitate, decarboxilare a ornitinei și dezvăluie în cele din urmă indolul.
Este recomandabil să îndepărtați aseptic 2 ml de mediu, să-l transferați într-un tub steril și să efectuați testul de indol acolo, astfel încât, dacă este negativ, restul tubului original să poată fi incubat încă 24 de ore, pentru a indole din nou..
Dezvoltarea indolului se realizează după cum urmează: în mediul MIO se adaugă 3 până la 5 picături de reactiv Kovacs și se agită energic. Se observă dacă apare sau nu un inel roșu fucsia.
Pregătirea
MIO mediu
Se cântăresc 31 g de mediu MIO și se dizolvă într-un litru de apă distilată..
Se încălzește până când amestecul fierbe timp de un minut, agitând frecvent până când agarul se dizolvă complet. Distribuiți 4 ml de mediu în eprubete 13/100 cu capace de bumbac.
Sterilizați în autoclavă la 121 ° C timp de 15 minute. Scoateți-l din autoclavă și lăsați-l să stea drept într-un raft, astfel încât să se formeze un bloc semi-solid.
A se păstra la frigider la 2-8 ° C. Se lasă să se încălzească înainte de a semăna tulpina bacteriană.
Culoarea mediului deshidratat este bej și cea a mediului preparat ușor violet opalescent..
PH-ul final al mediului preparat este de 6,5 ± 0,2
Mediul devine galben la pH acid și este purpuriu la pH alcalin.
Reactivul Kovacs (dezvoltator de test Indole)
Acest reactiv este preparat după cum urmează:
Se măsoară 150 ml alcool amilic, izoamilic sau butilic (oricare dintre cele trei). În ea se dizolvă 10 g de p-dimetilaminobenzaldehidă. Ulterior, se adaugă încet 50 ml de acid clorhidric concentrat..
Reactivul preparat este incolor sau galben deschis. Ar trebui păstrat într-o sticlă de chihlimbar și păstrat la frigider. O culoare maro închis arată deteriorarea sa.
De asemenea, reactivul Kovacs poate fi înlocuit cu reactivul Ehrlich. Acesta din urmă, fiind mai sensibil, este preferat să dezvăluie indol în bacterii care îl produc în cantități mici, cum ar fi în unele tije Gram negative care nu fermentează și anaerobi..
Utilizare
Acest mediu este un test care completează o baterie de teste biochimice pentru identificarea bacteriilor aparținând familiei Enterobacteriaceae..
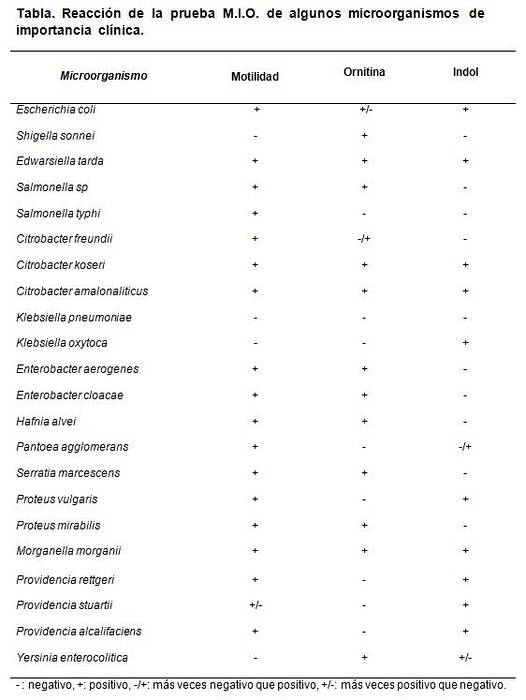
Datele despre decarboxilarea ornitinei servesc la diferențierea dintre Shigella sonnei, care dă pozitiv, de Shigella boydii, Shigella flexneri și S. dysenterieae, care dau negative.
De asemenea, diferențiază genul Klebsiella, care testează negativ, de genul Enterobacter, unde majoritatea speciilor sale sunt pozitive..
QA
De fiecare dată când se pregătește un lot de mediu MIO, se poate efectua un test de control. Pentru aceasta, tulpinile cunoscute sau certificate sunt utilizate pentru a observa comportamentul mediului..
Tulpinile care pot fi utilizate sunt Escherichia coli, Morganella morganii, Klebsiella pneumoniae, Enterobacter aerogenes Da Proteus mirabilis.
Rezultatele așteptate sunt E. coli și M. morganii. Dan M: +, I: + și O: +.
Klebsiella pneumoniae dă tot negativ (M: -, I: -, O :-). Proteus mirabilis Da Enterobacter aerogenes dați M: + I: - și O: +.
Referințe
- Mac Faddin J. (2003). Teste biochimice pentru identificarea bacteriilor de importanță clinică. Ed. A 3-a Editorial Panamericana. Buenos Aires. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnosticul microbiologic Bailey & Scott. 12 ed. Editorial Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosticul microbiologic. A 5-a ed. Editorial Panamericana S.A. Argentina.
- Laboratoarele Britannia. MIO Medio 2015. Disponibil la: britanialab.com
- Laboratoarele BD. BBL Motility Indole Ornithine (MIO) Medium. 2007. Disponibil la: bd.com
- Laboratoarele Valtek. Mediu M.I.O. Motilitate, Indol, Ornitină. 2010. Disponibil la: andinamedica.com



Nimeni nu a comentat acest articol încă.