
Caracteristicile actuale ale modelului atomic, postulatele și oamenii de știință influenți

modelul atomic actual este cea care se bazează pe mecanica cuantică, în special pe ecuația Schrödinger, pe principiul excluderii Pauli și o proprietate a electronului numită a învârti sau a învârti.
Este modelul cel mai larg acceptat și utilizat în studiul structurii atomilor, moleculelor și reactivității chimice a elementelor, datorită preciziei predicțiilor sale și a relativității sale simple..

Acest model reprezintă evoluția mai multor modele atomice anterioare, precum modelul Rutherford și modelul Bohr - Sommerfeld, considerate modele clasice sau semiclasice..
În prezent, există teoretic modele mai complete decât modelul mecanic cuantic al lui Schrödinger, cum ar fi modelul Dirac-Jordan, care încorporează relativitatea specială și se bazează pe ecuația undei Dirac. În această ecuație, spinul, proprietatea electronilor menționați la început, apare în mod natural.
Există, de asemenea, modele bazate pe teoria cuantică a câmpurilor, aplicate în fizica energiei înalte. Aceste modele sunt excelente pentru a prezice crearea și anihilarea particulelor fundamentale, scopul acestui domeniu al fizicii..
Merită menționat faptul că cele mai sofisticate teorii converg la aceleași rezultate ca și cele ale ecuației Schrödinger, în special pentru atomii de lumină..
Indice articol
- 1 Caracteristicile modelului atomic actual
- 1.1 Dualitatea undă-particulă
- 1.2 Dimensiunea atomului
- 2 Postulate ale modelului atomic actual
- 3 Oamenii de știință care influențează modelul atomic actual
- 4 Articole de interes
- 5 Referințe
Caracteristicile modelului atomic actual
În viziunea actuală a atomului, bazată pe mecanica cuantică non-relativistă, conceptul de orbite electronice în stilul sistemelor planetare nu se potrivește.
Cu toate acestea, imaginea cea mai răspândită a atomului este încă cea a unui nucleu central pozitiv și a câtorva puncte de sarcină electrică negativă (electroni), care se rotește pe orbite perfect definite în jurul nucleului central. Dar, în ciuda rădăcinilor sale, nu mai corespunde modelului atomic actual.
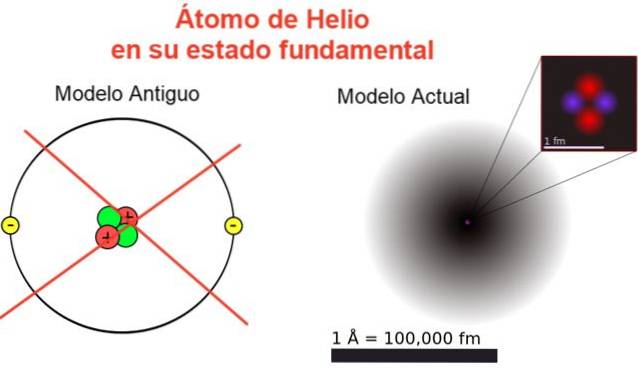
Figura 2 prezintă imaginea veche și imaginea actuală a unui atom de heliu în starea sa cea mai scăzută de energie (nivel n = 1 și l = 0).
Imaginea clasică este utilă pentru a vedea că nucleul conține doi protoni și doi neutroni. Garantând neutralitatea atomului există doi electroni care ocupă același nivel de energie.
Restul este o imagine departe de realitate, întrucât scara nucleului nici măcar nu corespunde cu cea a atomului: nucleul este de 1/100000 ori dimensiunea atomului, dar acolo este concentrată masa atomică..
Dualitatea undă-particulă
Mecanica clasică stabilește că fiecare particulă materială are o undă asociată, numită funcția de undă. Acesta este faimosul dualitatea undă-particulă de Louis De Broglie.
În modelul atomic actual, comportamentul electronului la scara atomilor este evident ca de undă, în timp ce la nivel macroscopic, la fel ca electronii care se deplasează în tuburile cu raze catodice ale televizoarelor vechi, predomină comportamentul corpuscular..
Pe de altă parte, cu fotonii, se întâmplă opusul, în majoritatea fenomenelor optice (la nivel macroscopic) au un comportament fundamental al undelor. Și atunci când interacționează cu atomii de materie, au un comportament de particule.
Din această cauză, electronii din jurul nucleului sunt împrăștiați în zone numite orbitali atomici, a căror formă și întindere vor depinde de nivelul de energie al electronilor și de impulsul unghiular.
Atât energia cât și impulsul unghiular al electronului din jurul nucleului au anumite valori permise, prin urmare se spune că sunt cuantificat.
Ecuația undei Schrödinger prezice care sunt valorile de energie și moment unghiular permise, precum și funcția de undă asociată fiecărui nivel de energie și momentum..
Pătratul matematic al funcției de undă determină orbitalele, adică zonele din jurul nucleului unde electronii pot fi găsiți cu probabilitate mai mare.
Mărimea atomului
Pentru a avea o imagine la scară a modelului atomic actual, să ne imaginăm că un atom are un diametru ca cel al unui teren de fotbal. Nucleul ar fi ca o furnică în centrul câmpului, dar uimitor cu 99,9% din masa atomică.
Pe de altă parte, electronii ar fi ca niște jucători fantomatici difuzați pe tot terenul, cu o probabilitate mai mare de a fi găsiți în mijlocul terenului..
Există câteva alinieri sau modalități permise de a ocupa câmpul, care depind de energia jucătorilor (electronii) și de cantitatea de „rotire” sau rotire în jurul centrului..
Postulatele modelului atomic actual
1.- Electronul se caracterizează prin masa sa m, prin rotirea sa s și pentru că este particula care poartă o sarcină elementară negativă (-e).
2.- Electronii au comportament dublu, de undă-particulă simultană, dar în funcție de energia lor și de amploarea fenomenului, unul poate fi mai preponderent decât celălalt..
3.- Electronii înconjoară nucleul atomic pozitiv, în așa fel încât să garanteze neutralitatea electrică a atomului. Prin urmare, numărul de electroni este egal cu numărul de protoni; Acesta este numar atomic, care dă caracteristicile chimice și fizice ale fiecărui element.
4.- Interacțiunea dintre electroni și nucleu este modelată de potențialul V (r) Coulomb electrostatic, la care termenul de energie potențială este încorporat în operatorul hamiltonian.
5.- Termenul de energie cinetică în operatorul hamiltonian este un operator care este construit din operatorul de impuls liniar, fiind același:
p = - i ħ ∂ / ∂r
Unde ħ este constanta lui Planck împărțită la 2π.
6.- Operatorul hamiltonian H = (p⋅p)/ 2m - e V (r) acționează asupra funcției de undă electronică Ψ (r).
7.- Pe măsură ce se caută soluțiile staționare ale funcției de undă electronică, se folosește ecuația Schrödinger independentă de timp:
H Ψ (r) = E Ψ (r)
Unde E reprezintă energia totală a electronului.
8.- La atomii cu mai mulți electroni, interacțiunea dintre ei nu este luată în considerare.
9.- Când vine vorba de atomi ai multor electroni, orbitalii electronii externi sunt modelați de potențialul nucleului protejat de electronii interiori, cunoscut sub numele de potențial Debye..
10.- Ecuația (7) are o soluție pentru unele valori discrete ale energiei, astfel încât celebrul planck quanta, apar în mod natural din soluțiile ecuației Schrödinger.
11.- Pentru fiecare valoare discretă a lui E există o funcție de undă. Dar unele soluții sunt degenerate, în funcție de valoarea impulsului unghiular L.
12.- Funcția de undă este produsul unei funcții radiale, a funcției azimutale și a funcției polare.
13.- Această funcție de undă determină regiunile permise pentru electron. Pătratul funcției de undă este probabilitate densitate pentru a găsi electronul într-o anumită poziție, văzut din centrul nucleului atomic.
14.- Spinul nu apare în ecuația Schrödinger, dar este încorporat în modelul atomic prin principiul Pauli:
Electronul este un fermion cu două stări de spin posibile + ½ și -½.
Deci aceeași stare caracterizată prin numerele cuantice n, l, m ale ecuației Schrödinger, poate fi ocupată de cel mult 2 electroni cu rotiri opuse. În acest fel, rotirea devine al patrulea număr cuantic.
Oamenii de știință influenți în actualul model atomic
Pare incredibil, dar majoritatea fizicienilor care au contribuit la modelul atomic actual apar în aceeași fotografie. S-au întâlnit la celebrele conferințe sponsorizate de Ernest Solvay, chimist și industrial de origine belgiană, devenit celebru în lumea științei.
Au început să aibă loc în 1911 și au reunit cei mai mari oameni de știință ai momentului, printre ei fiind practic toți cei care și-au dat contribuția la modelul atomic actual..
Cea mai faimoasă dintre aceste conferințe a avut loc la Bruxelles în 1927 și această fotografie istorică a fost făcută acolo:


- Peter debye
- Irving langmuir
- Martin Knudsen
- Auguste Piccard
- Max planck
- William Lawrence Bragg
- Emile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Edouard Herzen
- Hendrik Antoon Lorentz
- Théophile de Donder
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-Émile Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Max născut
- Charles Thomson Rees Wilson
- Ralph howard fowler
- Léon Brillouin
- Niels Bohr
- Owen Williams Richardson
Articole de interes
Modelul atomic al lui Schrödinger.
Modelul atomic de Broglie.
Modelul atomic Chadwick.
Modelul atomic Heisenberg.
Modelul atomic al lui Perrin.
Modelul atomic al lui Thomson.
Model atomic Dalton.
Model atomic Dirac Jordan.
Model atomic al lui Democrit.
Modelul atomic al lui Leucipp.
Modelul atomic Bohr.
Referințe
- Alonso - Finn. Fundamente cuantice și statistice. Addison Wesley.
- Bauer, W. 2011. Fizică pentru inginerie și științe. Volumul 1. Mc Graw Hill.
- Eisberg și Resnick. Fizică cuantică. Limusa - Wiley.
- Wikipedia. Teoria atomică. Recuperat de pe: es.wikipedia.com
- Zapata F. Modelul cuantico-mecanic al atomului. Recuperat de pe: lifeder.com



Nimeni nu a comentat acest articol încă.