
Structura, proprietățile și utilizările azotatului de calciu (Ca (NO3) 2)

azotat de calciu este o sare anorganică terțiară a cărei formulă chimică este Ca (NO3)Două. Din formula sa se știe că solidul său este compus din ioni de Ca.Două+ si nu3- într-un raport 1: 2. Prin urmare, este un compus de natură pur ionică..
Una dintre proprietățile sale este caracterul său oxidant, datorat anionului nitrat. Nu este combustibil, adică nu arde la temperaturi ridicate. Fiind incombustibil, reprezintă un solid sigur de manipulat fără prea multă îngrijire; cu toate acestea, poate accelera aprinderea materialelor combustibile.

Aspectul său constă dintr-un solid granular, care are o culoare albă sau gri deschis (imaginea superioară). Poate fi anhidru sau tetrahidrat, Ca (NO3)Două4HDouăO. Este foarte solubil în apă, metanol și acetonă.
Azotatul de calciu a fost utilizat pe scară largă ca îngrășământ, deoarece se deplasează ușor în solul umed și este absorbit rapid de rădăcinile plantelor. Oferă două elemente importante pentru nutriția și creșterea plantelor: azot și calciu.
Azotul este unul dintre cele trei elemente esențiale pentru dezvoltarea plantelor (N, P și K), este esențial în sinteza proteinelor. Între timp, calciul este necesar pentru a menține structura peretelui celular al plantei. Din acest motiv Ca (NR3)Două o mulțime merge la grădini.
Pe de altă parte, această sare are acțiuni toxice, în special prin contactul direct cu pielea și ochii, precum și prin inhalarea prafului. În plus, poate fi descompus prin încălzire.
Indice articol
- 1 Structura azotatului de calciu
- 2 Proprietăți fizice și chimice
- 2.1 Denumiri chimice
- 2.2 Formula moleculară
- 2.3 Greutate moleculară
- 2.4 Aspect fizic
- 2.5 Punctul de fierbere
- 2.6 Punct de topire
- 2.7 Solubilitatea în apă
- 2.8 Solubilitatea în solvenți organici
- 2.9 Aciditate (pKa)
- 2.10 Densitate
- 2.11 Descompunerea
- 2.12 Profil reactiv
- 3 utilizări
- 3.1 Agricultură
- 3.2 Beton
- 3.3 Tratarea apelor uzate sau a apelor uzate
- 3.4 Efectuarea de comprese reci
- 3.5 Coagularea latexului
- 3.6 Transferul și stocarea căldurii
- 4 Formulare de cerere
- 5 Referințe
Structura azotatului de calciu
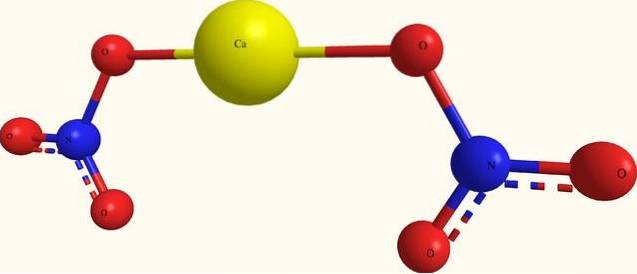
Imaginea superioară arată structura Ca (NO3)Două într-un model de sfere și bare. Totuși, aici există un defect: se presupune existența legăturilor covalente de Ca-O, ceea ce contrazice caracterul lor ionic. Clarificând acest lucru, într-adevăr interacțiunile sunt de tip electrostatic.
Cationul CaDouă+ se înconjoară cu doi NO anioni3- după proporțiile sale pe sticlă. Prin urmare, azotul predomină sub formă de azotat în structura cristalină..
Ionii sunt grupați în așa fel încât să stabilească o configurație a cărei expresie minimă este celula unitară; care, pentru sarea anhidră, este cubică. Adică, din cuburi care conțin raportul 1: 2 pentru acești ioni, se reproduce întregul cristal.
Pe de altă parte, sarea tetrahidrat, Ca (NO3)Două4HDouăSau are patru molecule de apă pentru fiecare set de NO3- ACDouă+ NU3-. Aceasta modifică structura cristalină, deformând-o într-o unitate celulară monoclinică..
Prin urmare, se așteaptă ca cristalele atât pentru sărurile anhidre, cât și pentru cele tetrahidrat să fie diferite; diferențe care pot fi determinate în proprietățile lor fizice, de exemplu punctele de topire.
Proprietati fizice si chimice
Denumiri chimice
-Azotat de calciu
-Dinitrat de calciu
-Nitrocalcit
-Salpetru norvegian și limesaltpetro.
Formulă moleculară
Spout3)Două sau CaNDouăSAU6
Greutate moleculară
Anhidru 164,088 g / mol și tetrahidrat 236,15 g / mol. Rețineți efectul apei asupra greutății moleculare și nu poate fi neglijat atunci când îl cântăriți..
Aspectul fizic
Solide sau granule albe sau gri deschis. Cristale albe cubice sau granule deliquescente; adică absorb umezeala până la punctul în care se dizolvă ca urmare a solubilității lor ridicate.
Punct de fierbere
Forma anhidră se descompune la încălzire la o temperatură care împiedică determinarea punctului său de fierbere; în timp ce forma tetrahidrat a sării are un punct de fierbere de 132ºC (270ºF, 405K).
Punct de topire
-Formă anhidră: 561 ° C până la 760 mmHg (1042 ° F, 834 K).
-Formă tetrahidrat: 42,7 ° C (109 ° F, 316 K).
Aceasta arată modul în care moleculele de apă interferează cu interacțiunile electrostatice dintre Ca.Două+ si nu3- în interiorul cristalelor; și în consecință, solidul se topește la o temperatură mult mai scăzută.
Solubilitatea apei
-Formă anhidră: 1212 g / L la 20 ° C.
-Forma tetrahidrat: 1290 g / L la 20 ° C.
Apa din cristale crește cu greu solubilitatea sării.
Solubilitate în solvenți organici
-În etanol, 51,42 g / 100 g la 20 ° C.
-În metanol, 134 g / 100 g la 10 ° C.
-În acetonă, 168 g / 100 g la 20 ° C.
Aciditate (pKa)
6.0
Densitate
2,5 g / cm3 la 25 ºC (tetrahidrat).
Descompunere
Când azotatul de calciu este încălzit până la incandescență, acesta se descompune în oxid de calciu, oxid de azot și oxigen..
Profil reactiv
Este un agent puternic oxidant, dar nu este combustibil. Accelerează aprinderea materialelor combustibile. Împărțirea azotatului de calciu în particule fine, facilitează explozia acestuia atunci când compusul este expus la foc prelungit.
Amestecurile cu esteri alchilici devin explozivi prin originarea esterilor de azotat de alchil. Combinația de azotat de calciu cu fosfor, clorură de staniu (II) sau alt agent reducător, poate reacționa exploziv.
Aplicații
agricultură
Este folosit în culturi ca sursă de azot și calciu. Azotatul de calciu este foarte solubil în apă și este ușor absorbit de rădăcinile plantelor. În plus, nu acidifică solurile, deoarece ionii săi nu pot fi hidrolizați în mod semnificativ..
Amestecarea cu îngrășăminte care conțin fosfor sau sulfat trebuie evitată pentru a evita formarea de săruri insolubile. Datorită higroscopicității sale, ar trebui păstrat într-un mediu uscat și răcoros.
Utilizarea acestuia are un avantaj față de utilizarea azotatului de amoniu ca îngrășământ. Deși acest ultim compus contribuie cu azot la plante, acesta interferează cu absorbția calciului, care ar putea duce la un deficit de calciu la plante..
Calciul contribuie la menținerea structurii peretelui celular al plantelor. În prezența unui deficit de calciu, țesuturile în creștere ale plantelor, cum ar fi vârfurile rădăcinii, frunzele tinere și vârfurile de lăstari, prezintă adesea o creștere distorsionată..
Amoniac scăzut
Azotatul de calciu reduce acumularea de acizi grași volatili și compuși fenolici, fitotoxici care se acumulează datorită descompunerii reziduurilor culturilor de soia.
În plus, există o tendință ca azotatul de calciu să scadă concentrația de amoniu din sol, ceea ce crește capacitatea de tamponare a hidrogenului..
Beton
Azotatul de calciu este utilizat pentru a reduce timpul de prindere al betonului. Aceasta este produsă prin generarea de hidroxid de calciu, poate printr-o reacție cu dublă deplasare..
În plus, azotatul de calciu induce generarea compusului de hidroxid de fier, a cărui acțiune de protecție asupra betonului reduce coroziunea acestuia. Adică fierul prezent poate reacționa cu componentele de bază ale betonului, cum ar fi hidroxidul de calciu în sine..
Azotatul de calciu scade timpul de fixare, precum și rezistența betonului, la care s-a adăugat cenușă vulcanică. Pentru a studia efectul adăugării azotatului de calciu în beton, au fost utilizate concentrații crescânde de azotat de calciu, între 2% și 10%..
A fost observată o scădere mai mare a timpului de fixare, precum și o creștere a rezistenței betonului, deoarece concentrația de azotat de calciu a crescut cu până la 10%.
Canalizare sau epurare a apelor uzate
Azotatul de calciu este utilizat pentru a reduce mirosurile din canalizare prin reducerea generării de hidrogen sulfurat. În plus, materia organică care generează condiții anaerobe este consumată, ceea ce face dificilă supraviețuirea multor specii biologice..
Realizarea de comprese reci
Azotatul de calciu tetrahidrat este un compus endoterm, adică are capacitatea de a absorbi căldura din mediul înconjurător. Aceasta produce o răcire a corpurilor care vin în contact cu recipientele care îl conțin..
Compresele își măresc temperatura, iar pentru a le regenera este suficient să le așezați într-un congelator
Coagularea latexului
Azotatul de calciu este utilizat în faza de coagulare a latexului. Face parte din soluția de imersie și, atunci când intră în contact cu soluția care conține latex, își rupe stabilizarea și provoacă coagularea..
Transferul și depozitarea căldurii
Amestecul binar de săruri azotate topite, inclusiv calciu cu alți nitrați, este utilizat în locul uleiului termic în centralele solare pentru transferul și stocarea căldurii.
Forme de cerere
-Azotatul de calciu se aplică amestecat cu solul la o concentrație de 1,59 kg la 30,48 mDouă, cu udare adecvată. Azotatul de calciu este solubilizat în apă, permițând absorbția acestuia de către rădăcinile plantei. În culturile hidroponice se dizolvă în apa în creștere.
-Azotatul de calciu este, de asemenea, utilizat sub formă de spray pentru pulverizarea frunzelor și florilor, fiind un tratament eficient în prevenirea putrezirii florii de roșii, a petelor de plută și a gropii amare a mărului..
-O cantitate de azotat de calciu se adaugă amestecului de formare a betonului (ciment, nisip, pietre și apă) și se determină efectul pe care îl are adăugarea acestuia asupra proprietăților specifice ale betonului; precum setarea vitezei și puterii.
-Azotatul de calciu este adăugat la o concentrație adecvată pentru a reduce mirosurile din canalizare sau ape uzate, până la un nivel pe care mirosurile sunt tolerabile pentru oameni.
Referințe
- Bonnie L. Grant. (2019). Îngrășământ cu azotat de calciu - Ce face azotatul de calciu pentru plante. Recuperat de pe: gardeningknowhow.com
- Farquharson, B.F., Vroney, R.P., Beauchamp, E.G. și Vyn, T.J. (1990). Utilizarea azotatului de calciu pentru a reduce acumularea de fitotoxine în timpul descompunerii reziduurilor corpului. Jurnalul canadian al științei solului 70 (4): 723-726.
- Ogunbode, E. B. și Hassan, I.O. (2011). Efectul adăugării azotatului de calciu asupra proprietăților selective ale betonului care conține cenușă vulcanică. Leonardo Electronic Journal of Practices Technologies 19: 29-38.
- Wikipedia. (2019). Azotat de calciu. Recuperat de pe: en.wikipedia.org
- Shiqi Dong și col. (2018). Inhibarea coroziunii oțelului de azotat de calciu în medii fluide de completare îmbogățite cu halogenuri. npj Volumul de degradare a materialelor 2, numărul articolului: 32.
- Emaginationz Technologies. (2019). Specificații nitrat de calciu. Recuperat de la: direct2farmer.com
- PubChem. (2019). Azotat de calciu. Recuperat de la: pubchem.ncbi.nlm.nih.gov

Nimeni nu a comentat acest articol încă.