
Azotat de magneziu (Mg (NO3) 2) structură, proprietăți, utilizări

azotat de magneziu este un solid anorganic a cărui formulă chimică este Mg (NO3)Două. Este un compus ionic format prin unirea unui cation de magneziu MgDouă+ și doi anioni nitrați NO3-.
Mg (NR3)Două este un solid cristalin alb. Este foarte higroscopic, adică absoarbe cu ușurință apa din mediu. Când rămâne în contact cu aerul înconjurător, tinde să-și formeze hexahidratul de Mg (NO3)Două•6HDouăSAU.

Nitrat de magneziu Hexahidrat Mg (NR3)Două•6HDouăO are în structura sa cristalină 6 molecule de apă HDouăSau pentru fiecare moleculă de Mg (NO3)Două. Azotatul de magneziu se găsește în peșteri și mine sub formă de nitromagnezit mineral.
Mg (NR3)Două obținut comercial prin reacția magneziului metalic Mg cu acidul azotic HNO3.
Are o mare varietate de utilizări, de exemplu în agricultură ca îngrășământ, deoarece furnizează substanțe nutritive pentru plante precum azot (N) și magneziu (Mg)..
Este utilizat în artificii sau în industria pirotehnică și, de asemenea, în obținerea acidului azotic concentrat. Utilizat în analize chimice, experimente de fizică și studii medicale și științifice.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Punctul de fierbere
- 3.5 Densitate
- 3.6 Solubilitate
- 3.7 Efectul încălzirii
- 4 Obținerea
- 4.1 Amplasarea în natură
- 5 utilizări
- 5.1 În studii recente
- 5.2 În studiile de boală
- 6 Referințe
Structura
Azotatul de magneziu anhidru este alcătuit dintr-un cation de magneziu MgDouă+ și doi anioni nitrați NO3-.
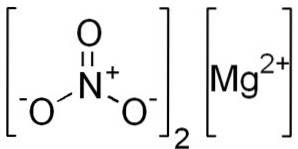
Ion magneziu MgDouă+ posedă configurație electronică: 1sDouă, 2sDouă 2 P6, 3s0, deoarece a cedat cei doi electroni ai învelișului exterior (3s). Această conformație este foarte stabilă.
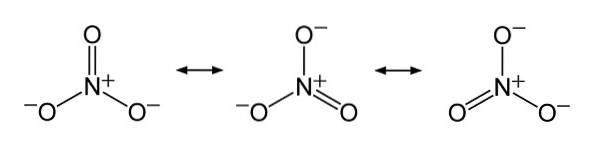
Ionul NO3- are o structură plană și simetrică.
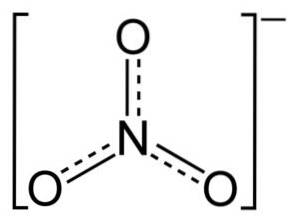
În structura NO3- sarcina negativă este distribuită continuu între cei trei atomi de oxigen.
Nomenclatură
-Azotat de magneziu anhidru: Mg (NO3)Două
-Azotat de magneziu dihidrat: Mg (NO3)Două•2HDouăSAU
-Azotat de magneziu hexahidrat: Mg (NO3)Două•6HDouăSAU
-Dinitrat de magneziu
Proprietăți
Starea fizică
-Mg (NR3)Două anhidru: solid alb, cristale cubice.
-Mg (NR3)Două dihidrat: solid cristalin alb.
-Mg (NR3)Două hexahidrat: cristale monoclinice solide incolore
Greutate moleculară
-Mg (NR3)Două anhidru: 148,31 g / mol
-Mg (NR3)Două hexahidrat: 256,41 g / mol
Punct de topire
-Mg (NR3)Două hexahidrat: 88,9 ºC
Punct de fierbere
-Mg (NR3)Două hexahidrat: nu fierbe, se descompune la 330 ° C
Densitate
-Mg (NR3)Două anhidru: 2,32 g / cm3
-Mg (NR3)Două dihidrat: 1,456 g / cm3
-Mg (NR3)Două hexahidrat: 1.464 g / cm3
Solubilitate
Azotatul de magneziu anhidru este foarte solubil în apă: 62,1 g / 100 ml la 0 ° C; 69,5 g / 100 ml la 20 ° C. De asemenea, este foarte higroscopic, fiind în contact cu aerul formează rapid hexahidratul.
Mg (NR3)Două dihidratul este, de asemenea, foarte solubil în apă și etanol. Este higroscopic.
Mg (NR3)Două hexahidratul este, de asemenea, foarte solubil în apă. Este moderat solubil în etanol. Este cel mai stabil dintre cele trei în contact cu aerul, adică dintre cele trei este cel care absoarbe cea mai puțină apă din mediu.
Efect de încălzire
Prin supunerea unei soluții apoase de Mg (NO3)Două La evaporarea apei, sarea care cristalizează este hexahidratul: Mg (NO3)Două•6HDouăO. Hexahidrat înseamnă că în solid fiecare moleculă de Mg (NO3)Două este legat de 6 molecule de apă.
Există, de asemenea, dihidratul Mg (NO3)Două•2HDouăSau, în care Mg (NR3)Două solidul este legat de 2 molecule de apă.
Încălzire Mg hexahidrat (NR3)Două•6HDouăSau sarea anhidră nu se obține, deoarece azotatul de magneziu are o afinitate mare pentru apă.
Din acest motiv, atunci când este încălzit peste punctul său de topire, formează inițial o sare amestecată de azotat de magneziu și hidroxid Mg (NO3)Două•4Mg (OH)Două.
Această sare amestecată, la atingerea a 400 ° C, se descompune în oxid de magneziu MgO și se degajă gaze oxid de azot..
Obținerea
Poate fi preparat prin reacția carbonatului de magneziu MgCO3 cu acid azotic HNO3, degajând dioxid de carbon CODouă:
MgCO3 + 2 HNO3 → Mg (NR3)Două + CODouă↑ + HDouăSAU
Se poate obține și cu hidroxid de magneziu Mg (OH)Două și acid azotic:
Mg (OH)Două + 2 HNO3 → Mg (NR3)Două + 2 oreDouăSAU
Din punct de vedere comercial se obține în mai multe moduri:
1- Reacția magneziului metalic Mg cu acidul azotic HNO3.
2- Prin reacția oxidului de magneziu MgO cu acidul azotic HNO3.
3- Legarea hidroxidului de magneziu Mg (OH)Două și azotat de amoniu NH4NU3, formând azotatul de magneziu odată cu evoluția amoniacului NH3.
Locație în natură
Mg (NR3)Două hexahidratul apare în mod natural în mine și peșteri sau peșteri sub formă de nitromagnezit mineral.
Acest mineral este prezent atunci când guanoul intră în contact cu roci bogate în magneziu. Guano este materialul rezultat din excrementele păsărilor marine și focilor în medii foarte uscate..
Aplicații
Mg (NR3)Două hexahidratul este utilizat în industria ceramică, chimică și agricolă.
Acest compus este un îngrășământ deoarece furnizează azot (N), care este unul dintre cele trei elemente de bază cerute de plante, și magneziu (Mg), care este o componentă secundară, care este, de asemenea, importantă pentru plante..
În acest fel este utilizat cu alte ingrediente în sere și în cultivarea hidroponică. Acesta din urmă constă în cultivarea plantelor într-o soluție apoasă cu săruri de îngrășăminte în loc de sol.

De asemenea, este utilizat ca catalizator în obținerea compușilor petrochimici. Permite reglarea vâscozității în anumite procese. Azotatul de magneziu anhidru este utilizat în pirotehnică, adică pentru fabricarea artificiilor.

Azotatul de magneziu anhidru este un agent de deshidratare. Se folosește, de exemplu, pentru a obține acid azotic concentrat, deoarece elimină apa și concentrează vaporii de acid până la 90-95% HNO3.

De asemenea, este utilizat pentru acoperirea azotatului de amoniu și pentru a permite formarea de margele din acest material comprimat..
Este util în formularea cernelurilor, a tonerului (pulbere neagră utilizată în sistemele de fotocopiere) și a produselor colorante. Servește ca un standard de magneziu în chimia analitică.
Sarea azotatului de magneziu și a ceriului Mg (NO3)Două•Se încrunta3)3 Este de interes în experimentele de fizică la temperaturi scăzute, deoarece este utilizat ca agent de răcire în experimentele de demagnetizare adiabatică (fără transfer de căldură).
Această sare de magneziu și ceriu a fost utilizată pentru a stabili niveluri de temperatură extrem de scăzute pe scara Kelvin (aproape de zero absolut)..
În studiile recente
Mai mulți cercetători au folosit Mg (NO3)Două în compoziții cu polimeri sintetici și naturali pentru a crește conductivitatea în bateriile ion magneziu.
De asemenea, a fost investigat în construcția de supercondensatoare pentru stocarea energiei de mare putere.
În studiile de boală
Azotatul de magneziu a fost administrat șobolanilor de laborator cu hipertensiune arterială (presiune ridicată) și sa constatat că scade efectiv tensiunea arterială și atenuează sau înmoaie efectele complicațiilor acestei boli..
De asemenea, a arătat efecte protectoare împotriva tulburărilor neurologice (tulburări neuronale) și împotriva morții la șobolani în timpul proceselor de obturare a arterei carotide..
Referințe
- Qian, M. și colab. (2018). Carboni extraordinari poroși, cu puține straturi, cu capacitate ridicată din combustia Pechini de gel de azotat de magneziu. ACS Appl Mater Interfaces 2018, 10 (1): 381-388. Recuperat de la ncbi.nlm.nih.gov.
- Manjuladevi, R. și colab. (2018). Un studiu privind amestecul de electroliți polimerici pe bază de poli (alcool vinil) -pol (acrilonitril) cu azotat de magneziu pentru bateria de magneziu. Ionics (2018) 24: 3493. Recuperat de pe link.springer.com.
- Kiruthika, S. și colab. (2019). Electrolit biopolimeric ecologic, pectină cu sare de azotat de magneziu, pentru aplicare în dispozitive electrochimice. J Solid State Electrochem (2019) 23: 2181. Recuperat de pe link.springer.com.
- Vilskerts R. și colab. (2014). Azotatul de magneziu atenuează creșterea tensiunii arteriale la șobolanii SHR. Magnes Res 2014, 27 (1): 16-24. Recuperat de la ncbi.nlm.nih.gov.
- Kuzenkov V.S. și Krushinskii A.L. (2014). Efectul protector al azotatului de magneziu împotriva tulburărilor neurologice provocate de ischemie cerebrală la șobolani. Bull Exp Biol Med 2014, 157 (6): 721-3. Recuperat de la ncbi.nlm.nih.gov.
- Ropp, R.C. (2013). Grupul 15 (N, P, As, Sb și Bi) Compuși alcalini-pământeni. Nitrat de magneziu. În Enciclopedia compușilor alcalini ai pământului. Recuperat de la sciencedirect.com.
- Kirk-Othmer (1994). Enciclopedia Tehnologiei Chimice. Volumul 1. Ediția a patra. John Wiley & Sons.
- S.U.A. Biblioteca Națională de Medicină. (2019). Nitrat de magneziu. Recuperat de la: pubchem.ncbi.nlm.nih.gov.



Nimeni nu a comentat acest articol încă.