
Istoricul nemetalelor, proprietăți, grupuri, utilizări
fără metale Acestea sunt un grup de elemente care sunt situate pe partea dreaptă a tabelului periodic, cu excepția hidrogenului care este situat în grupa 1 (IA), împreună cu metalele alcaline. Dacă doriți să știți care sunt acestea, trebuie să vă uitați la colțul din dreapta sus al blocului p.
Atomii nemetalici sunt relativ mici, iar carcasa lor electronică exterioară are un număr mare de electroni. Printre elementele nemetalice pot fi solide, lichide și gaze; deși majoritatea sunt într-o stare gazoasă, mai multe dintre ele îmbogățind atmosfera.
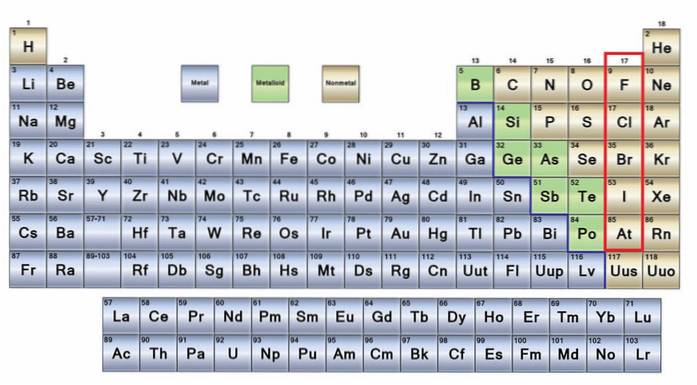
O bună parte a nemetalelor sunt prezente la toate ființele vii sub formă de compuși și macromolecule. De exemplu: carbonul, oxigenul și hidrogenul sunt prezente în toate proteinele, lipidele, carbohidrații și acizii nucleici.
Fosforul este prezent în toți acizii nucleici și în unii carbohidrați și lipide. Sulful se găsește în multe proteine. Azotul face parte din toți acizii nucleici și proteinele.
Pe de altă parte, gazele subterane, metanul și țițeiul sunt compuse aproape în întregime din elemente nemetalice. De fapt, hidrocarburile (carbonul și hidrogenul) oferă o idee despre cât de abundente sunt nemetalele, în ciuda numărului mai mic de elemente din tabelul periodic..
Indice articol
- 1 Istorie
- 2 Proprietăți fizice și chimice
- 2.1 Fizica
- 2.2 Chimie
- 3 Grupuri de nemetale și elemente
- 3.1 Grupa 1
- 3.2 Grupa 14
- 3.3 Grupa 15
- 3.4 Grupa 16
- 3.5 Grupa 17
- 3.6 Grupa 18
- 4 utilizări
- 4.1 Hidrogen
- 4.2 Carbon
- 4.3 Azot
- 4.4 Fosfor
- 4.5 Oxigen
- 4.6 Sulf
- 4.7 Seleniu
- 4.8 Fluor
- 4.9 Clor
- 4.10 Brom
- 4.11 Iod
- 4.12 Heliu
- 4.13 Neon
- 4.14 Argon
- 4.15 Xenon
- 4.16 Radon
- 5 Referințe
Poveste
Din cele mai vechi timpuri (3750 î.Hr.), egiptenii foloseau cărbunele pentru a reduce cuprul prezent în mineralele lor, cum ar fi corvellite și malachit..
În 1669, Hennin Brand a reușit să izoleze fosforul din urina colectată. Henry Cavendish (1776) a reușit să identifice hidrogenul, deși mai mulți cercetători, inclusiv Robert Boyle (1670), au produs hidrogen prin reacția unui acid puternic cu un metal.
Carl Scheele a produs oxigen prin încălzirea oxidului de mercur cu nitrați (1771). Curtois a reușit să izoleze iodul, în timp ce încerca să pregătească salpeter din alge marine (1811). Balard și Gmelin izolat brom (1825).
În 1868, Janssen și Lockger au descoperit independent heliul prin observarea unei linii galbene în studiul spectrului luminii solare care nu aparținea altui element. Moissan a reușit izolarea fluorului (1886).
În 1894, Lord Rayleigh și Ramsey au descoperit argonul prin studierea proprietăților azotului. Ramsay și Travers (1898) au izolat criptonul, neonul și xenonul din argonul lichid prin distilarea criogenică a aerului..
Proprietati fizice si chimice

Fizic
Unele dintre proprietățile fizice ale nemetalelor sunt:
-Au o conductanță electrică scăzută, cu excepția carbonului sub formă de grafit, care este un bun conductor de electricitate..
-Ele pot apărea sub aspectul fizic al solidelor, lichidelor sau gazelor.
-Au o conductanță termică scăzută, cu excepția carbonului sub formă de diamant, care nu se comportă ca un izolator termic..
-Au luciu redus, spre deosebire de luciul metalic al metalelor.
-Solidele nemetalice sunt fragile, deci nu sunt ductile sau maleabile.
-Au puncte de topire și fierbere scăzute.
-Pot avea structuri cristaline diferite. Astfel, fosforul, oxigenul și fluorul au o structură cristalină cubică; hidrogen, carbon și azot, hexagonal; și sulf, clor, brom și iod, ortorombic.
Chimie
Nemetalele se caracterizează prin faptul că au o energie de ionizare ridicată și o valoare electronegativitate ridicată. Fluorul, de exemplu, are cea mai mare electronegativitate (3,98), fiind cel mai reactiv element al nemetalelor.
Dar, în mod surprinzător, gazele nobile heliu (5,5) și neon (4,84) au cea mai mare electronegativitate. Cu toate acestea, acestea sunt inerte din punct de vedere chimic, deoarece carcasele electronice exterioare sunt umplute..
Nemetalele formează compuși ionici cu metale și covalenți cu nemetali.
Elementele nemetalice se găsesc formând molecule diatomice, legate prin legături covalente. Între timp, atomii gazelor nobile sunt sub formă de unități atomice.
Formează oxizi acizi care, atunci când reacționează cu apa, dau naștere la acizi.
Grupuri și elemente nemetalice
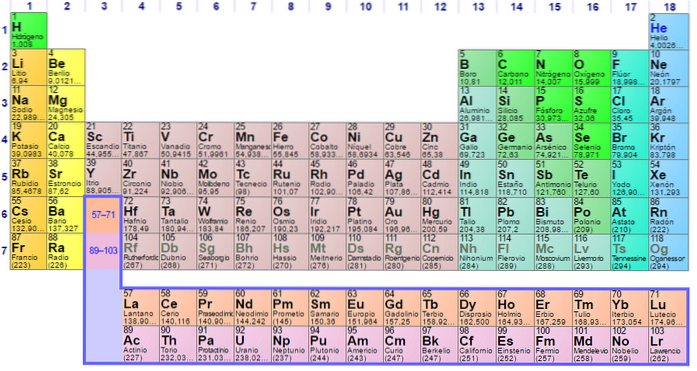
Grupa 1
Este alcătuit din hidrogen, un gaz incolor și inodor, diatomic. Stare de oxidare +1. Are o densitate mai mică decât aerul. În stare solidă are o structură cristalină hexagonală. Hidrogenul este un element slab reactiv.
Grupa 14
Carbonul este singurul nemetal din acest grup. Carbonul sub formă de grafit este un solid strălucitor, cu o structură cristalină hexagonală. Are o conductivitate electrică ridicată. Cele mai frecvente stări de oxidare ale sale sunt +2 și +4.
Grupa 15
Azot
Gaz incolor și inodor. Este un element ușor reactiv și puțin mai dens decât aerul. Cele mai frecvente stări de oxidare: -3 și +5. Formează molecule diatomice, NDouă.
Meci
Solid, culoarea sa poate fi albă, galbenă sau neagră. Puțin reactiv. Structură cristalină ortorombică. Electronegativitate 2.1. Cele mai frecvente stări de oxidare: -3 și +5.
Grupa 16
Oxigen
Gaz incolor sau albastru pal, inodor. În general non-reactiv. Structură cristalină cubică. Este un izolator și un agent oxidant puternic. Electronegativitate 3.5. Starea de oxidare -2
Sulf
Solid galben strălucitor, fragil, moderat reactiv. Structură cristalină ortorombică. Formează legături covalente. Electronegativitate 2.5. Cele mai frecvente stări de oxidare: -2, +2, +4 și +6.
Seleniu
Cenușiu solid sau roșiatic până la negru. Seleniul gri prezintă o conductivitate electrică sensibilă la lumină. Este un solid moale și fragil. Electronegativitate 2.4. Stări de oxidare: -2, +2, +4 și +6.
Grupa 17
Fluor
Este un gaz galben pal, foarte toxic. Este un element foarte reactiv. Apare ca molecule diatomice, FDouă. În stare solidă cristalizează sub formă cubică. Electronegativitate 3,98. Stări de oxidare -1.
Clor
Este un gaz verde-galben. Prezintă molecule diatomice, ClDouă. Este foarte reactiv. În stare solidă structura cristalină este ortorombică. Electronegativitate 3.0. Stări de oxidare: - 1, +1, +3, +5, +7.
Brom
Este un lichid roșu-maroniu. Electronegativitate 2.8. Stări de oxidare -1, +1, +3, +5 și +7.
Iod
Este un solid negru care, atunci când este sublimat, emite vapori violet. Structură cristalină ortorombică. Iodurile metalice sunt ionice. Electronegativitate 2.5. Stări de oxidare: -1, +1, +3, +5 și +7.
Astatus
Este un negru solid. Structură cristalină cubică centrată pe față. Electronegativitate 2.2. Este un agent oxidant slab.
Grupa 18
Heliu
Are o conductivitate termică ridicată. Electronegativitate 5.5. Este chimic inert și neinflamabil. Densitate redusă și fluiditate mare.
Neon
Capacitate mare de răcire în stare lichidă. Electronegativitate 4.84. Este cel mai puțin reactiv dintre gazele nobile.
Argon
Este mai dens decât aerul. Inert din punct de vedere chimic. Electronegativitate 3.2.
Krypton
Electronegativitate 2.94. Poate reacționa cu fluor pentru a forma difluorură de cripton (KrFDouă).
Xenon
Trece bariera hematoencefalică. Răspunde la curent electric producând lumină. Electronegativitate 2.2. Formează complexe cu fluor, aur și oxigen.
Radon
Este un element radioactiv. Electronegativitate 2.06. Formează compuși cu fluor (RnFDouă) și cu oxigen (RnO3).
Aplicații
Hidrogen
Este utilizat în propulsia rachetelor și ca combustibil în motoarele auto care utilizează hidrogen. Este utilizat în sinteza amoniacului (NH3) și în hidrogenarea grăsimilor.
Carbon

Grafitul este utilizat la fabricarea creioanelor și a fibrelor de înaltă rezistență care sunt utilizate la fabricarea articolelor sportive. Diamantul este folosit ca o bijuterie de mare valoare și în găuri de foraj ca un abraziv. Dioxidul de carbon este utilizat în producția de băuturi carbogazoase.
Azot
Se utilizează în producția de amoniac, acid azotic și uree. Azotul este un element esențial pentru plante și este utilizat la fabricarea îngrășămintelor.
Meci
Fosforul alb este folosit ca rodenticid, insecticid și în industria artificiilor. Fosforul roșu este folosit pentru a face chibrituri. Compușii săi sunt utilizați și în producția de îngrășăminte.
Oxigen
Oxigenul este utilizat la fabricarea oțelului, materialelor plastice și a textilelor. Este, de asemenea, utilizat în propulsori de rachete, oxigenoterapie și asistență respiratorie în aeronave, submarine și zboruri spațiale..
Sulf
Este folosit ca materie primă pentru producerea de acid sulfuric, praf de pușcă și pentru vulcanizarea cauciucurilor. Sulfiții sunt folosiți pentru decolorarea hârtiei și în fungicid.
Seleniu
Se folosește pentru a conferi sticlei o nuanță roșu stacojiu. Este, de asemenea, utilizat pentru neutralizarea nuanței verzui produse de contaminarea sticlei cu compuși de fier. Este utilizat în celule fotoelectrice cu aplicare în uși și lifturi.
Fluor

Se adaugă pastelor de dinți pentru prevenirea cariilor. Fluorura de hidrogen este utilizată ca materie primă pentru teflon. Fluorul monatomic este utilizat la fabricarea semiconductoarelor.
Clor
Este utilizat în metalurgia extractivă și în clorurarea hidrocarburilor pentru fabricarea diferitelor produse, cum ar fi PVC. Clorul este utilizat în pulpa de lemn și înălbitorile textile. Este, de asemenea, utilizat ca dezinfectant pentru apă.
Brom
Se folosește la prepararea bromurii de argint pentru lentilele sensibile la lumină și la filmul fotografic. Este, de asemenea, utilizat la fabricarea bromurii de sodiu sedative și a dibrometanului, o componentă antiderapantă a benzinei.
Iod
Se adaugă iodură de potasiu (KI) pentru a preveni gușa tiroidiană. Tinctura de iod este utilizată ca antiseptic și germicid. Iodul face parte din hormonii tiroidieni.
Heliu
Se utilizează la umplerea baloanelor cu aer cald și amestecat cu oxigen pentru respirația în adâncime. Este utilizat pentru sudarea într-o atmosferă inertă și, de asemenea, ajută la menținerea temperaturilor foarte scăzute în cercetare.
Neon
În tuburi de sticlă care sunt iluminate de acțiunea electricității (lumini neon roșii).
Argon
Folosit pentru a crea o atmosferă pentru sudare și la umplerea becurilor incandescente.
Xenon
Un amestec de xenon și kripton este utilizat la producerea de blițuri de intensitate mare în expuneri fotografice scurte.
Radon
Este utilizat în tratamentul tumorilor canceroase prin radioterapie.
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Mathews, C. K., van Holde, K. E. și Ahern, K. G. (2002). Biochimie. A treia editie. Editați | ×. Pearson-Addison Wesley
- Helmenstine, Anne Marie, dr. (06 octombrie 2019). Care sunt proprietățile nemetalelor? Recuperat de pe: thoughtco.com
- Wikipedia. (2019). Metaloid. Recuperat de pe: en.wikipedia.org
- Editorii Enciclopediei Britanice. (5 aprilie 2016). Metaloid. Encyclopædia Britannica. Recuperat de pe: britannica.com
- José M. Gavira Vallejo. (2016, 27 ianuarie). Care sunt elementele poligenice? Și icosagenii, cristalogenii, calcogenii ...? Recuperat de pe: triplenlace.com



Nimeni nu a comentat acest articol încă.