
Structura chimică a pentanonului, proprietăți, sinteză, utilizări
pentanonă este un compus organic, aparținând familiei cetonice, a cărui formulă chimică este C5H10O. Este încă una dintre cele mai simple cetone și constă dintr-un lichid incolor cu o aromă similară cu acetonă. Din acest moment, în ceea ce privește numărul de carbon al scheletului lor, cetonele prezintă izomerism de poziție.
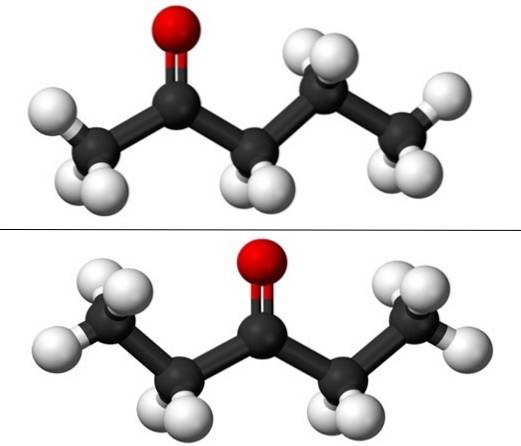
Când se vorbește despre izomerism de poziție, se referă la locul unde este gruparea carbonil, C = O. Astfel, pentanona constă de fapt din doi compuși cu proprietăți fizice care diferă ușor unul de altul: 2-pentanonă și 3-pentanonă (imaginea de jos). Ambele sunt lichide, dar punctele lor de fierbere sunt aceleași, deci nu pot fi separate prin distilare..
Cu toate acestea, fiecare dintre cele două pentanone are propria cale sintetică, deci este puțin probabil să existe un amestec al acestora; amestec care poate fi fezabil să se separe prin congelare.
Utilizările lor sunt restricționate în special ca solvenți organici; alternative la acetonă în medii în care este utilizată la o temperatură mai mare decât punctul său de fierbere scăzut. În mod similar, acestea sunt materiale de pornire pentru alte sinteze organice, deoarece grupul lor C = O poate fi redus sau poate fi supus adăugării nucleofile..
Indice articol
- 1 Structura chimică
- 1.1 Izomeri de poziție
- 1.2 Interacțiuni intermoleculare
- 1.3 Cristale
- 2 Proprietăți
- 2.1 Aspect fizic
- 2.2 Masa molară
- 2.3 Densitatea
- 2.4 Punct de topire
- 2.5 Punctul de fierbere
- 2.6 Solubilitatea în apă
- 2.7 Presiunea vaporilor
- 2.8 Punct de aprindere
- 2.9 Stabilitate
- 3 Sinteza
- 3.1 2-pentanonă
- 3,2 3-pentanonă
- 4 utilizări
- 5 Referințe
Structura chimică
Izomerii de poziție
În imagine avem structurile moleculare ale celor doi izomeri poziționali pentru pentanonă, reprezentați printr-un model de sfere și bare. Sferele negre corespund scheletelor de carbon, cele albe atomilor de hidrogen, iar cele roșii atomilor de oxigen din grupul C = O..
2-pentanonă
2-pentanona (de mai sus) are grupa C = O în cel de-al doilea carbon, care este echivalent cu acela dacă ar fi în al patrulea; adică 2-pentanonă și 4-pentanonă sunt echivalente, deoarece este suficient să le rotiți la 180º astfel încât structurile lor să fie aceleași.
În stânga lui C = O este un radical metil, CH3-, iar în dreapta lui, un radical propilic. De aceea, această cetonă se mai numește (mai puțin frecvent utilizată) metil propil cetonă (MPK). Puteți vedea asimetria acestei structuri la prima vedere.
3-pentanonă
3-pentanona (de jos) are grupul C = O pe al treilea carbon. Rețineți că acest izomer este o versiune mai mare de acetonă și că este, de asemenea, foarte simetric; cei doi radicali de pe laturile grupului C = O sunt aceiași: doi radicali etilici, CH3CHDouă-. Acesta este motivul pentru care 3-pentanona se mai numește dietil cetonă (sau dimetil acetonă).
Interacțiuni intermoleculare
Prezența grupării carbonil, atât în 2-pentanonă, cât și în 3-pentanonă, conferă polaritate moleculei.
Prin urmare, ambii izomeri ai pentanonei sunt capabili să interacționeze între ei prin forțe dipol-dipol, în care cea mai mare densitate a sarcinii negative, δ-, văzută într-o hartă a potențialului electrostatic, va fi orientată în jurul atomului de oxigen..
La fel, forțele de dispersie din Londra intervin într-un grad mai mic între scheletele carbonizate și hidrogenate..
Deoarece pentanona are o zonă și o masă moleculară mai mari în comparație cu acetonă, această contribuție se adaugă momentului său dipolar și îi permite să aibă un punct de fierbere mai mare (102 ° C> 56 ° C). De fapt, cei doi izomeri se vaporizează la 102 ° C; în timp ce îngheață la diferite temperaturi.
Cristale
Probabil simetriile joacă un rol important în cristalizare. De exemplu, punctul de topire al 2-pentanonei este de -78 ° C, în timp ce cel al 3-pentanonei, -39 ° C.
Aceasta înseamnă că cristalele de 3-pentanonă sunt mai stabile în raport cu temperatura; moleculele sale sunt mai coezive și necesită mai multă căldură pentru a se separa în faza lichidă.
Dacă ar exista un amestec de ambii izomeri, 3-pentanona ar fi prima care cristalizează, 2-pentanona fiind ultima la o temperatură mai scăzută. Cele mai simetrice molecule de 3-pentanonă se orientează mai ușor decât cele ale 2-pentanonei: asimetrice și în același timp mai dinamice.
Proprietăți
Aspectul fizic
Lichide incolore cu o aromă similară cu acetonă.
Masă molară
86,13 g / mol
Densitate
0,81 g / ml (3-pentanonă)
0,809 g / ml (2-pentanonă)
Punct de topire
-78 ºC (2-pentanonă)
-39 ºC (3-pentanonă)
Punct de fierbere
102 ºC (pentru ambii izomeri)
Solubilitatea apei
35 g / L (3-pentanonă)
60 g / L (2-pentanonă)
Presiunea de vapori
35 mmHg (3-pentanonă)
270 mmHg (2-pentanonă) la 20 ° C
Aceste valori nu sunt utile pentru a compara direct presiunile de vapori ale ambilor izomeri, deoarece prima este raportată fără temperatura la care a fost măsurată..
Punct de aprindere
12,78 ° C (3-pentanonă)
10 ºC (2-pentanonă)
Stabilitate
Cei doi izomeri ai pentanonei sunt extrem de inflamabili, deci ar trebui să fie păstrați cât mai departe de orice sursă de căldură. Punctele de aprindere indică faptul că o flacără poate aprinde vaporii ambelor pentanone chiar și la o temperatură de 10 ° C..
Sinteză
Deși cei doi izomeri ai pentanonei sunt foarte asemănători din punct de vedere fizic și chimic, căile lor sintetice sunt independente unul de celălalt, deci este puțin probabil ca ambii să fie obținuți în aceeași sinteză.
2-pentanonă
Pornind de la reactivul 2-pentanol, un alcool secundar, acesta poate fi oxidat la 2-pentanonă folosind acidul hipocloros format in situ, HClO, ca agent oxidant. Oxidarea ar fi:
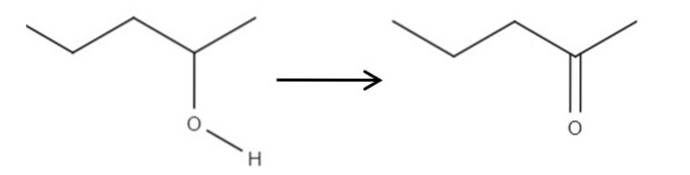
Pur și simplu legătura C-OH devine C = O. Există și alte metode de sintetizare a 2-pentanonei, dar dintre toate acestea este cel mai ușor de înțeles..
3-pentanonă
3-pentanona poate fi sintetizată prin decarboxilarea cetonică a acidului propanoic, CH3CHDouăCOOH. Această cale sintetică produce cetone simetrice și constă dintr-o moleculă de CH3COOH va pierde grupul COOH ca CODouă, în timp ce cealaltă grupul său OH sub forma de HDouăSAU:
2CH3CHDouăCOOH => CH3CHDouăMașinăDouăCH3 + CODouă + HDouăSAU
O altă cale oarecum mai complexă este de a reacționa direct un amestec de etilenă, CHDouă= CHDouă, CODouă si HDouă pentru a forma 3-pentanonă.
Aplicații
Cu excepția cazului în care aplicația este foarte riguroasă, este o sinteză specifică sau s-a demonstrat, de asemenea, că cei doi izomeri nu produc aceleași rezultate, este irelevant să alegeți între utilizarea 2-pentanonei sau a 3-pentanonei în oricare dintre utilizările lor..
Cu alte cuvinte, „nu contează” dacă doriți să utilizați 2-pentanonă sau 3-pentanonă ca solvent pentru vopsele sau rășini sau ca degresant, deoarece cele mai importante criterii vor fi prețul și disponibilitatea acesteia. 3-pentanona este utilizată în industria auto pentru a studia comportamentul gazelor din motoarele cu ardere internă.
Referințe
- Morrison, R. T. și Boyd, R, N. (1987). Chimie organica. Ediția a V-a. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (Ediția a X-a.). Wiley plus.
- Wikipedia. (2019). 3-Pentanonă. Recuperat de pe: en.wikipedia.org
- Centrul Național pentru Informații despre Biotehnologie. (2019). 2-pentanonă. Baza de date PubChem. CID = 7895. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Societatea Regală de Chimie. (2019). 3-Pentanonă. Recuperat de pe: chemspider.com
- Profesorul T. Nalli. (2013). Oxidarea 2-pentanolului și distilarea produsului. Recuperat de la: course1.winona.edu


Nimeni nu a comentat acest articol încă.