
Propilenă Structură chimică, proprietăți și utilizări

propilenă sau propena la temperatura ambiantă și presiunea atmosferică este în stare gazoasă și, ca și alte alchene, este incoloră. Are un miros similar cu uleiul, dar mai puțin intens. Prezintă un moment dipolar întrucât, deși îi lipsește o legătură polară puternică, molecula sa este asimetrică.
De asemenea, propilena este un izomer structural al ciclopropanului (au aceeași formulă chimică C3H6). Apare în natură ca o consecință a proceselor de vegetație și fermentare. Este produs în mod artificial în timpul procesării combustibililor fosili precum petrolul, gazele naturale și, într-o măsură mai mică, carbonul.

În mod similar, etilena și propilena sunt produse de rafinare a petrolului într-un proces de divizare a moleculelor mari de hidrocarburi pentru a genera hidrocarburi mici la mare cerere..
Propilena poate fi obținută și folosind diferite metodologii:
- Prin reacția reversibilă a etilenei și butenei, unde legăturile duble sunt rupte și reformulate pentru a da propilenă.
- Printr-un proces de dehidrogenare (pierdere de hidrogen) a propanului.
- Ca parte a unui program de producere a olefinelor din metanol (MTO), propilena a fost produsă din metanol. Acesta a fost trecut prin catalizatorul zeolit, care favorizează deshidratarea acestuia și duce la formarea etilenei și propilenei..
3CH3OH (metanol) => CH3CH = CHDouă (propilenă) + 3HDouăO (apă)
Indice articol
- 1 Structura chimică
- 2 Proprietăți
- 2.1 Greutatea moleculară
- 2.2 Punctul de fierbere
- 2.3 Punctul de topire
- 2.4 Punct de aprindere
- 2.5 Solubilitate
- 2.6 Solubilitatea exprimată ca masă
- 2.7 Densitate
- 2.8 Densitatea vaporilor
- 2.9 Presiunea vaporilor
- 2.10 Autoinflamare
- 2.11 Vâscozitatea
- 2.12 Căldura de ardere
- 2.13 Căldura de vaporizare
- 2.14 Tensiunea superficială
- 2.15 Polimerizare
- 2.16 Punct de îngheț
- 2.17 Pragul mirosului
- 3 utilizări
- 3.1 Polipropilenă
- 3.2 Acrilonitril
- 3.3 Oxid de propilenă
- 3.4 Pentru sinteza alcoolilor și a altor utilizări
- 4 Referințe
Structura chimică
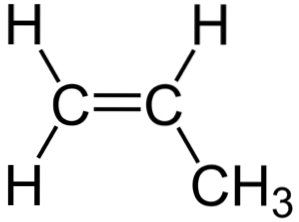
În imaginea superioară puteți vedea structura chimică a propilenei, în care iese în evidență asimetria sa (partea dreaptă este diferită de stânga). Scheletul său de carbon, cu excepția atomilor de H, poate fi văzut ca un bumerang.
Acest bumerang are o legătură nesaturată sau dublă pe una dintre laturile sale (C1) și astfel este plat datorită hibridizării spDouă de atomi de carbon.
Cu toate acestea, cealaltă parte este ocupată de gruparea metil (-CH3), a cărui hibridizare este sp3 și are o geometrie tetraedrică. Astfel, văzut din față, bumerangul este plat, cu atomii de H care ies din el la aproximativ 109,5º.
În faza gazoasă, molecula interacționează slab cu altele prin forțe de dispersie. La fel, interacțiunile dintre legăturile duble (π-π) a două molecule de propilenă sunt prevenite de gruparea metil.
Acest lucru are ca rezultat o scădere a forțelor sale intermoleculare, care se reflectă în proprietățile sale fizice. Doar la temperaturi foarte scăzute, propilena poate adopta o structură solidă, în care bumerangul rămâne grupat cu interacțiunile lor slabe.
Proprietăți
Este un gaz incolor cu miros aromat. Se transportă sub formă de gaz lichefiat și, atunci când scapă din recipientele care îl conțin, o face sub formă de gaz sau lichid. La concentrații scăzute formează un amestec exploziv și inflamabil cu aerul, densitatea propilenei fiind mai mare decât cea a aerului..
Greutate moleculară
42,081 g / mol
Punct de fierbere
53,9ºF la 760mmHg
48 ºC la 760 mmHg
Punct de topire
301,4 ºF
185 ºC
Punct de aprindere
162ºF
Solubilitate
44,6 ml / 100 ml în apă.
1.250 ml / 100 ml în etanol.
524,5 ml / 100ml în acid acetic.
Solubilitatea exprimată ca masă
200 mg / l 25 ºC
Densitate
0,609 mg / ml la -52,6º F
0,5139 la 20 ° C
Densitatea vaporilor
1,46 la 32 ° F (relativ la aer luat ca referință).
1,49 (aer = 1).
1,91 kg / m3 la 273,15 ºK
Presiunea de vapori
1 mmHg la -205,4ºF
760 mmHg la -53,9ºF
8,69 × 103 mmHg la 25 ºC (valoare extrapolată).
1.158 kPa la 25 ° C
15,4 atm la 37 ° C
Auto-aprindere
851ºF
455 ºC
Viscozitate
83,4 micropoza la 16,7 ºC.
Căldura de ardere
16.692 BTU / lb
10.940 cal / g
Căldura de vaporizare
104,62 cal / g (la punctul de fierbere)
Tensiune de suprafata
16,7 dynes / cm la 90 ° C
Polimerizare
Polimerizează la temperaturi ridicate și presiuni ridicate în prezența catalizatorilor.
Templeratura de inghet
185,25 ° C.
Pragul mirosului
10-50 mg / m3 (detectare)
100 mg / m3 (recunoaştere)
Aplicații
Este utilizat în industria petrochimică ca agent combustibil și alchilant. În industria chimică este utilizată ca materie primă pentru producerea și sinteza a numeroși derivați.
Este util în principal în producția de polipropilenă, acrilonitril (ACN), oxid de propilenă (PO), alcooli, cumen și acizi acrilici.
Polipropilenă
Polipropilena este unul dintre principalele materiale plastice utilizate în accesorii electronice și electrice, articole de uz casnic, capace pentru sticle și valize..
Materialul laminat este utilizat la ambalarea dulciurilor, etichetelor, discurilor compacte etc., în timp ce fibrele sunt utilizate pentru a confecționa foldere și haine..
Acrilonitril
Polimerii și fibrele elastomerice sunt obținute din acrilonitril. Aceste fibre sunt utilizate pentru fabricarea diferitelor forme de îmbrăcăminte, cum ar fi pulovere, șosete și îmbrăcăminte sport. Ele sunt, de asemenea, utilizate în mobilier de casă, pliante, tapițerie, perne și pături..
OXIDUL Propilenei
Oxidul de propilenă participă ca component la sinteza poliuretanului. Acesta este utilizat la fabricarea spumei flexibile și a spumei rigide. Spuma flexibilă este utilizată ca material de umplutură în mobilierul de casă și în industria auto.
Pe de altă parte, spuma rigidă este utilizată în principal ca material de izolare a clădirilor..
De asemenea, oxidul de propilenă este utilizat în producția de propilen glicol. Acest compus este utilizat la fabricarea rășinilor poliesterice nesaturate și ca antigel..
În plus, oxidul de propilenă este utilizat la producerea eterului de propilen glicol. Acest eter se aplică în fabricarea vopselelor, hainelor, cernelurilor, rășinilor și produselor de curățat.
Pentru sinteza alcoolului și alte utilizări
Propilena permite obținerea unor alcooli, printre care izopropanolul, utilizat ca solvent în cosmetice și produse de îngrijire personală. În plus, îndeplinește funcția de agent antiseptic.
- Isopropanolul este implicat în fabricarea vopselelor, rășinilor, cernelurilor și benzilor adezive. Este, de asemenea, utilizat în industria farmaceutică.
- Oxo-alcoolul 2-etilhexanol este utilizat în producția de ftalat, plastifianți, materiale adezive și vopsele.
- Butanolul este utilizat la fabricarea vopselelor, acoperirilor, rășinilor, coloranților, produselor farmaceutice și polimerilor.
Pe de altă parte, cumenul este produs din combinația de propilenă și benzen. Cumenul este principalul compus în fabricarea fenolului și acetonului, utilizat într-o varietate de produse, cum ar fi policarbonat, rășini fenolice, rășini epoxidice și metacrilat de metil..
În cele din urmă, acidul acrilic - un alt produs derivat din propilenă - este utilizat la producerea esterilor și rășinilor acrilice pentru vopsele, acoperiri și aplicații adezive..
Referințe
- Michal Osmenda. (26 decembrie 2007). Aprinde-mi focul. [Figura]. Adus pe 23 mai 2018, de pe: commons.wikimedia.org
- Grupul Linde. (2018). Propilenă. Adus pe 23 mai 2018, de pe: linde-gas.com
- Wikipedia. (2018). Propenă. Adus pe 23 mai 2018, de pe: en.wikipedia.org
- PubChem. (2018). Propilenă. Adus pe 27 mai 2018, de la: pubchem.ncbi.nlm.nih.gov
- Vesovic Velisa. (7 februarie 2011). Propilenă. Adus pe 27 mai 2018, de pe: thermopedia.com
- Jeffrey S. Plotkin. (2016, 8 august). The Propylene Quandary. Adus pe 27 mai 2018, de pe: acs.org
- ICIS. (6 noiembrie 2017). Utilizările propilenei și datele de piață. Adus pe 27 mai 2018, de pe: icis.com


Nimeni nu a comentat acest articol încă.