
Ce este densitatea electronilor?
densitatea electronilor este o măsură a probabilității de a găsi electronul într-o anumită regiune a spațiului; fie în jurul unui nucleu atomic, fie în „vecinătățile” din cadrul structurilor moleculare.
Cu cât concentrația de electroni la un punct dat este mai mare, cu atât densitatea electronilor este mai mare și, prin urmare, se va distinge de mediul înconjurător și va prezenta anumite caracteristici care explică reactivitatea chimică. Un mod excelent și grafic de a reprezenta un astfel de concept este prin harta potențialului electrostatic.

De exemplu, imaginea superioară arată structura enantiomerului S-carnitină cu harta sa corespunzătoare a potențialului electrostatic. Se poate observa o scară compusă din culorile curcubeului: roșu pentru a indica regiunea cu cea mai mare densitate de electroni și albastru pentru acea regiune săracă în electroni..
Pe măsură ce molecula este traversată de la stânga la dreapta, ne îndepărtăm de grupul -CODouă- spre schelet CHDouă-CHOH-CHDouă, unde culorile sunt galben și verde, indicând o scădere a densității electronilor; până la grupul -N (CH3)3+, cea mai săracă regiune de electroni, colorată în albastru.
În general, regiunile în care densitatea electronilor este scăzută (cele colorate în galben și verde) sunt cele mai puțin reactive dintr-o moleculă..
Indice articol
- 1 Concept
- 2 Harta potențialului electrostatic
- 2.1 Compararea culorilor
- 2.2 Reactivitatea chimică
- 3 Densitatea electronilor în atom
- 4 Referințe
Concept
Mai mult decât chimic, densitatea electronilor are o natură fizică, deoarece electronii nu rămân statici, ci se deplasează dintr-o parte în alta creând câmpuri electrice..
Și variația acestor câmpuri determină diferențele în densitatea electronilor în suprafețele van der Waals (toate acele suprafețe ale sferelor).
Structura S-carnitinei este reprezentată de un model de sfere și bare, dar dacă ar fi prin suprafața sa van der Waals, barele ar dispărea și ar fi observat doar un set de sfere acoperite (cu aceleași culori).
Este mai probabil ca electronii să se afle în jurul atomilor mai electronegativi; cu toate acestea, poate exista mai mult de un atom electronegativ în structura moleculară și, prin urmare, grupuri de atomi care își exercită și propriul efect inductiv.
Acest lucru înseamnă că câmpul electric variază mai mult decât poate fi prezis prin observarea unei molecule din privirea unei păsări; adică poate exista mai multă sau mai puțină polarizare a sarcinilor negative sau a densității electronilor.
Acest lucru poate fi explicat și după cum urmează: distribuția sarcinii devine mai omogenă.
Harta potențialului electrostatic
De exemplu, deoarece grupul -OH are un atom de oxigen, acesta atrage densitatea electronică a atomilor vecini; cu toate acestea, în S-carnitină cedează o parte din densitatea sa de electroni către grupul -CODouă-, părăsind în același timp grupul -N (CH3)3+ cu deficiență electronică mai mare.
Rețineți că poate fi foarte dificil să se deducă cum funcționează efectele inductive într-o moleculă complexă, cum ar fi o proteină..
Pentru a avea o privire de ansamblu asupra acestor diferențe în câmpurile electrice din structură, se utilizează calculul de calcul al hărților de potențial electrostatic..
Aceste calcule constau în plasarea unei sarcini punctiforme pozitive și deplasarea ei de-a lungul suprafeței moleculei; acolo unde există o densitate mai mică a electronilor, va exista repulsie electrostatică și cu cât repulsia este mai mare, cu atât culoarea albastră va fi mai intensă.
Acolo unde densitatea electronilor este mai mare, va exista o atracție electrostatică puternică, reprezentată de culoarea roșie.
Calculele iau în considerare toate aspectele structurale, momentele dipolare ale legăturilor, efectele inductive cauzate de toți atomii extrem de electronegativi etc. Și, ca rezultat, veți obține acele suprafețe colorate și atrăgătoare din punct de vedere vizual..
Comparația culorilor
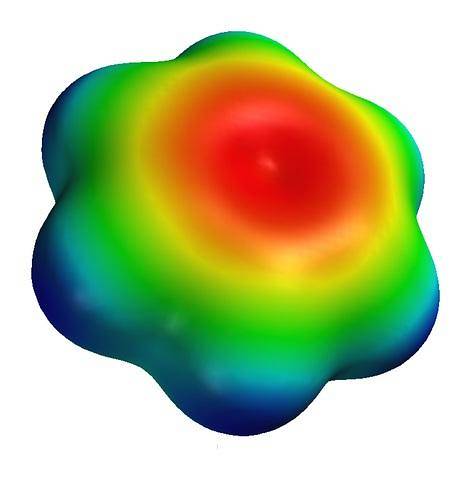
Deasupra este harta potențialului electrostatic pentru o moleculă de benzen. Rețineți că în centrul inelului există o densitate mai mare de electroni, în timp ce „vârfurile” sale sunt de culoare albăstruie, datorită atomilor de hidrogen mai puțin electronegativi. De asemenea, această distribuție a sarcinilor se datorează caracterului aromatic al benzenului.
În această hartă sunt observate și culorile verde și galben, indicând aproximările la regiunile sărace și bogate în electroni..
Aceste culori au propria scară, diferită de cea a S-carnitinei; și, prin urmare, este incorect să comparați grupul -CODouă- și centrul inelului aromatic, ambele reprezentate de culoarea roșie pe hărțile lor.
Dacă amândoi ar păstra aceeași scară de culoare, culoarea roșie de pe harta benzenului ar fi văzută pentru a transforma un portocaliu slab. Conform acestei standardizări, pot fi comparate hărțile de potențial electrostatic și, prin urmare, densitățile electronice ale diferitelor molecule..
În caz contrar, harta ar servi doar pentru a cunoaște distribuția sarcinii pentru o moleculă individuală..
Reactivitatea chimică
Prin observarea unei hărți a potențialului electrostatic și, prin urmare, a regiunilor cu densități mari și mici de electroni, se poate prezice (deși nu în toate cazurile) unde vor avea loc reacții chimice în structura moleculară..
Regiunile cu densitate mare de electroni sunt capabile să „furnizeze” electronii lor speciilor înconjurătoare care au nevoie sau au nevoie de ei; la aceste specii, încărcate negativ, E+, sunt cunoscuți sub numele de electrofili.
Prin urmare, electrofilii pot reacționa cu grupurile reprezentate de culoarea roșie (-CODouă- și centrul inelului benzenic).
În timp ce regiunile cu densitate mică de electroni, reacționează cu specii încărcate negativ sau cu cele care au perechi libere de electroni de împărțit; acestea din urmă sunt cunoscute sub numele de nucleofili.
În cazul -N (CH3)3+, va reacționa în așa fel încât atomul de azot câștigă electroni (reduce).
Densitatea electronilor în atom
În atom, electronii se mișcă la viteze enorme și pot fi în mai multe regiuni ale spațiului în același timp.
Cu toate acestea, pe măsură ce distanța de la nucleu crește, electronii dobândesc energie potențială electronică și distribuția lor probabilistică scade..
Aceasta înseamnă că norii electronici ai unui atom nu au o margine definită, ci una neclară. Prin urmare, nu este ușor să calculăm raza atomică; Cu excepția cazului în care există vecini care stabilesc o diferență în distanțele nucleelor lor, jumătate din care poate fi luată ca raza atomică (r = d / 2).
Orbitalele atomice și funcțiile lor de undă radială și unghiulară demonstrează modul în care densitatea electronilor se schimbă în funcție de distanța care le separă de nucleu..
Referințe
- Colegiul Reed. (s.f.). Ce este densitatea electronilor? ROCO. Recuperat din: reed.edu
- Wikipedia. (2018). Densitatea electronilor. Recuperat de pe: en.wikipedia.org
- Helmenstine, Anne Marie, dr. (11 iunie 2014). Definiția densității electronilor. Recuperat de pe: thoughtco.com
- Steven A. Hardinger. (2017). Glosar ilustrat de chimie organică: densitatea electronilor. Recuperat de la: chem.ucla.edu
- Chimie LibreTexte. (29 noiembrie 2018). Mărimi atomice și distribuții ale densității electronilor. Recuperat de pe: chem.libretexts.org
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (10a ediție.). Wiley plus.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.



Nimeni nu a comentat acest articol încă.