
Care sunt forțele Van der Waals?
Forțele Van der Waals sunt forțe intermoleculare de natură electrică care pot fi atractive sau respingătoare. Există o interacțiune între suprafețele moleculelor sau atomilor, diferită în esență de legăturile ionice, covalente și metalice care se formează în interiorul moleculelor..
Deși slabe, aceste forțe sunt capabile să atragă molecule de gaz; de asemenea, cea a gazelor lichefiate și solidificate și a tuturor lichidelor și solidelor organice. Johannes Van der Waals (1873) a fost cel care a dezvoltat o teorie pentru a explica comportamentul gazelor reale.

În așa-numita ecuație Van der Waals pentru gazele reale - (P + lanDouă/ VDouă) (V - nb)) = nRT- se introduc două constante: constanta b (adică volumul ocupat de moleculele de gaz) și „a”, care este o constantă empirică.
Constanta "a" corectează abaterea de la comportamentul așteptat al gazelor ideale la temperaturi scăzute, exact acolo unde este exprimată forța de atracție dintre moleculele de gaz. Capacitatea unui atom de a polariza în tabelul periodic crește de la partea de sus a unui grup la partea de jos a grupului și de la dreapta la stânga într-o perioadă..
Prin creșterea numărului atomic - și, prin urmare, a numărului de electroni - cei care se află în cochiliile exterioare sunt mai ușor de mișcat pentru a forma elemente polare..
Indice articol
- 1 Interacțiuni electrice intermoleculare
- 1.1 Interacțiunea dintre dipoli permanenți
- 1.2 Interacțiunea dintre un dipol permanent și un dipol indus
- 2 Forțele londoneze sau dispersia
- 3 aparate de radio Van der Waals
- 4 Forțele și energia interacțiunii electrice dintre atomi și între molecule
- 5 Referințe
Interacțiuni electrice intermoleculare
Interacțiunea dintre dipoli permanenți
Există molecule neutre din punct de vedere electric, care sunt dipoli permanenți. Acest lucru se datorează unei perturbări a distribuției electronice care produce o separare spațială a sarcinilor pozitive și negative către capetele moleculei, constituind un dipol (ca și cum ar fi un magnet).
Apa este formată din 2 atomi de hidrogen la un capăt al moleculei și un atom de oxigen la celălalt capăt. Oxigenul are o afinitate mai mare pentru electroni decât hidrogenul și îi atrage.
Acest lucru produce o deplasare a electronilor spre oxigen, lăsând acest lucru încărcat negativ și hidrogenul cu o sarcină pozitivă..

Sarcina negativă a unei molecule de apă poate interacționa electrostatic cu sarcina pozitivă a altei molecule de apă provocând o atracție electrică. Astfel, acest tip de interacțiune electrostatică se numește forțe Keesom.
Interacțiunea dintre un dipol permanent și un dipol indus
Dipolul permanent are ceea ce se numește moment dipol (µ). Magnitudinea momentului dipolar este dată de expresia matematică:
u = q.x
q = sarcină electrică.
x = distanța spațială între poli.
Momentul dipolar este un vector care, prin convenție, este reprezentat orientat de la polul negativ la polul pozitiv. Mărimea lui µ doare să se exprime în debye (3,34 × 10-30 Cm.
Dipolul permanent poate interacționa cu o moleculă neutră provocând o modificare a distribuției sale electronice, rezultând un dipol indus în această moleculă..
Dipolul permanent și dipolul indus pot interacționa electric, producând o forță electrică. Acest tip de interacțiune este cunoscut sub numele de inducție și forțele care acționează asupra ei se numesc forțe Debye..
Forțele londoneze sau dispersia
Natura acestor forțe de atracție este explicată de mecanica cuantică. Londra a postulat că, într-o clipă, în moleculele neutre din punct de vedere electric, centrul sarcinilor negative ale electronilor și centrul sarcinilor pozitive ale nucleelor ar putea să nu coincidă..
Deci, fluctuația densității electronilor permite moleculelor să se comporte ca dipoli temporari.
Aceasta nu este în sine o explicație pentru forțele de atracție, dar dipolii temporari pot induce polarizarea aliniată corect a moleculelor adiacente, rezultând în generarea unei forțe de atracție. Forțele de atracție generate de fluctuațiile electronice se numesc forțe londoneze sau dispersie..
Forțele Van der Waals prezintă anizotropie, motiv pentru care sunt influențate de orientarea moleculelor. Cu toate acestea, interacțiunile de tip dispersie sunt întotdeauna predominant atractive..
Forțele londoneze devin mai puternice pe măsură ce mărimea moleculelor sau atomilor crește.
La halogeni, moleculele F.Două și ClDouă numerele atomice mici sunt gaze. BRDouă cu cel mai mare număr atomic este un lichid și IDouă, halogenul cu cel mai mare număr atomic este un solid la temperatura camerei.
Creșterea numărului atomic crește numărul de electroni prezenți, ceea ce facilitează polarizarea atomilor și, prin urmare, interacțiunile dintre aceștia. Aceasta determină starea fizică a halogenilor.
Radio Van der Waals
Interacțiunile dintre molecule și dintre atomi pot fi atractive sau respingătoare, în funcție de distanța critică dintre centrele lor, care se numește rv.
La distanțe între molecule sau atomi mai mari decât rv, atracția dintre nucleele unei molecule și electronii celeilalte predomină asupra repulsiilor dintre nuclei și electronii celor două molecule.
În cazul descris, interacțiunea este atractivă, dar ce se întâmplă dacă moleculele se apropie la o distanță între centrele lor care este mai mică decât rv? Atunci forța respingătoare predomină asupra celei atractive, care se opune unei abordări mai strânse între atomi..
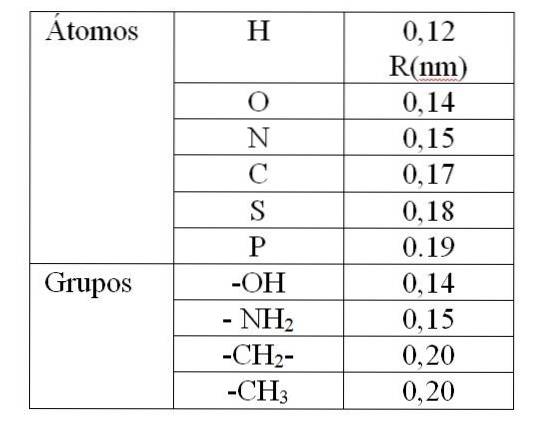
Valoarea lui rv Este dat de așa-numitele raze Van der Waals (R). Pentru molecule sferice și identice rv este egal cu 2R. Pentru două molecule diferite de raze R1 și RDouă: rv este egal cu R1 + RDouă. Valorile razelor Van der Waals sunt date în tabelul 1.
Valoarea dată în tabelul 1 indică o rază Van der Waals de 0,12 nm (10-9 m) pentru hidrogen. Apoi valoarea lui rv pentru acest atom este 0,24 nm. Pentru o valoare de rv mai puțin de 0,24 nm va produce o respingere între atomii de hidrogen.
Forțele și energia interacțiunii electrice dintre atomi și între molecule
Forța dintre o pereche de sarcini q1 si ceDouă, separat în vid de distanța r, este dat de legea lui Coulomb.
F = k. ce1.ceDouă/ rDouă
În această expresie k este o constantă a cărei valoare depinde de unitățile utilizate. Dacă valoarea forței - dată de aplicarea legii lui Coulomb - este negativă, aceasta indică o forță atractivă. Dimpotrivă, dacă valoarea dată pentru forță este pozitivă, aceasta indică o forță respingătoare.
Deoarece moleculele sunt de obicei într-un mediu apos care protejează forțele electrice exercitate, este necesar să se introducă termenul de constantă dielectrică (ε). Astfel, această constantă corectează valoarea dată forțelor electrice prin aplicarea legii lui Coulomb.
F = k.q1.ceDouă/ε.rDouă
În mod similar, energia pentru interacțiunea electrică (U) este dată de expresia:
U = k. ce1.ceDouă/ε.r
Referințe
- Editorii Enciclopediei Britanice. (2018). Forțele Van der Waals. Adus pe 27 mai 2018, de pe: britannica.com
- Wikipedia. (2017). Forțele Van der Waals. Adus pe 27 mai 2018, de pe: es.wikipedia.org
- Kathryn Rashe, Lisa Peterson, Seila Buth, Irene Ly. Forțele Van der waals. Adus pe 27 mai 2018, de pe: chem.libretexts.org
- Morris, J. G. (1974) Chimia fizică a unui biolog. 2 și ediție. Edward Arnold (Editori) Limitat.
- Mathews, C. K., Van Holde, K.E. și Ahern, K.G. (2002) Biochimie. A treia editie. Addison Wesley Longman, Inc..

Nimeni nu a comentat acest articol încă.