
Raza atomică cum este măsurată, cum se schimbă și exemple
radio atomic este un parametru important pentru proprietățile periodice ale elementelor din tabelul periodic. Este direct legată de mărimea atomilor, deoarece cu cât raza este mai mare, cu atât sunt mai mari sau mai voluminoase. De asemenea, este legat de caracteristicile lor electronice..
Cu cât un atom are mai mulți electroni, cu atât este mai mare dimensiunea și raza sa atomică. Ambele sunt definite de electronii învelișului de valență, deoarece la distanțe dincolo de orbite, probabilitatea de a găsi un electron se apropie de zero. Opusul se întâmplă în vecinătatea nucleului: crește probabilitatea de a găsi un electron.

Imaginea superioară reprezintă un ambalaj de bile de bumbac. Rețineți că fiecare este înconjurat de șase vecini, fără a lua în considerare un alt rând superior sau inferior posibil. Modul în care sunt compactate bilele de bumbac va defini dimensiunile și, prin urmare, razele lor; la fel ca atomii.
Elementele în funcție de natura lor chimică interacționează cu propriii lor atomi într-un fel sau altul. În consecință, magnitudinea razei atomice variază în funcție de tipul de legătură prezentă și de ambalarea solidă a atomilor săi..
Indice articol
- 1 Cum se măsoară raza atomică?
- 1.1 Determinarea distanței internucleare
- 1.2 Unități
- 2 Cum se schimbă în tabelul periodic?
- 2.1 Pe o perioadă
- 2.2 Coborâre printr-un grup
- 2.3 Contracția lantanidelor
- 3 Exemple
- 4 Referințe
Cum măsurați raza atomică?
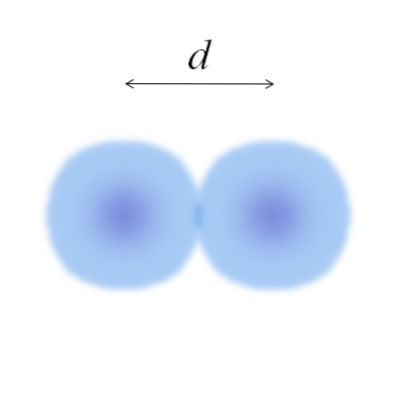
În imaginea principală poate fi ușor să măsurați diametrul bilelor de bumbac și apoi să îl împărțiți la două. Cu toate acestea, sfera unui atom nu este complet definită. De ce? Deoarece electronii circulă și se difuzează în regiuni specifice ale spațiului: orbitali.
Prin urmare, atomul poate fi considerat ca o sferă cu margini impalpabile, ceea ce este imposibil de spus cu certitudine până unde ajung. De exemplu, în imaginea de mai sus, regiunea centrului, aproape de nucleu, prezintă o culoare mai intensă, în timp ce marginile sale sunt neclare..
Imaginea reprezintă o moleculă diatomică EDouă (cum ar fi ClDouă, HDouă, SAUDouă, etc.). Presupunând că atomii sunt corpuri sferice, dacă s-a determinat distanța d care separă ambii nuclei în legătura covalentă, ar fi suficient să o împărțim în două jumătăți (d/ 2) pentru a obține raza atomică; mai precis, raza covalentă de la E la EDouă.
Ce se întâmplă dacă E nu a format legături covalente cu sine, ci a fost un element metalic? Atunci d ar fi indicat de numărul de vecini care înconjoară E în structura sa metalică; adică după numărul de coordonare (N.C) al atomului din interiorul ambalajului (amintiți-vă bile de bumbac din imaginea principală).
Determinarea distanței internucleare
A determina d, care este distanța internucleară pentru doi atomi într-o moleculă sau ambalaj, sunt necesare tehnici de analiză fizică.
Una dintre cele mai utilizate este difracția de raze X. În ea, un fascicul de lumină este iradiat printr-un cristal și este studiat modelul de difracție rezultat din interacțiunile dintre electroni și radiația electromagnetică. În funcție de ambalare, se pot obține diferite modele de difracție și, prin urmare, alte valori ale d.
Dacă atomii sunt „strânși” în rețeaua cristalină, vor prezenta valori diferite ale d în comparație cu ceea ce ar avea dacă ar fi „confortabili”. La fel, aceste distanțe internucleare ar putea fluctua în valori, astfel încât raza atomică constă de fapt într-o valoare medie a acestor măsurători..
Cum sunt legate raza atomică și numărul de coordonare? V. Goldschmidt a stabilit o relație între cele două, în care pentru un N.C de 12, valoarea relativă este 1; 0,97 pentru un ambalaj în care atomul are N.C egal cu 8; 0,96, pentru un N.C egal cu 6; și 0,88 pentru un N.C de 4.
Unități
Din valorile pentru N.C egale cu 12, multe dintre tabele au fost construite în care sunt comparate razele atomice ale tuturor elementelor tabelului periodic..
Deoarece nu toate elementele formează astfel de structuri compacte (N.C mai mici de 12), relația V. Goldschmidt este utilizată pentru a calcula razele lor atomice și a le exprima pentru același ambalaj. În acest fel, măsurătorile razelor atomice sunt standardizate..
Dar în ce unități sunt exprimate? Având în vedere d este de magnitudine foarte mică, trebuie să recurgem la unitățile angstrom Å (10 ∙ 10-10m) sau, de asemenea, utilizat pe scară largă, picometrul (10 ∙ 10-12m).
Cum se schimbă în tabelul periodic?
Peste o perioada
Razele atomice determinate pentru elementele metalice se numesc raze metalice, în timp ce pentru elementele nemetalice, razele covalente (cum ar fi fosforul, P4, sau sulf, S8). Cu toate acestea, între cele două tipuri de spițe există o distincție mai proeminentă decât cea a numelui.
De la stânga la dreapta în aceeași perioadă, nucleul adaugă protoni și electroni, dar aceștia din urmă sunt limitați la același nivel de energie (numărul cuantic principal). În consecință, nucleul exercită o sarcină nucleară eficientă din ce în ce mai mare asupra electronilor de valență, care contractă raza atomică..
În acest fel, elementele nemetalice din aceeași perioadă tind să aibă raze atomice (covalente) mai mici decât metalele (raze metalice).
Coborând printr-un grup
Pe măsură ce coborâți printr-un grup, sunt activate noi niveluri de energie, care permit electronilor să aibă mai mult spațiu. Astfel, norul electronic acoperă distanțe mai mari, periferia sa estompată ajunge să se îndepărteze mai mult de nucleu și, prin urmare, raza atomică se extinde..
Contracția lantanidelor
Electronii din carcasa interioară ajută la protejarea sarcinii nucleare efective pe electronii de valență. Când orbitalele care alcătuiesc straturile interioare au multe „găuri” (noduri), așa cum se întâmplă cu orbitalele f, nucleul contractă puternic raza atomică datorită efectului lor scăzut de protecție..
Acest fapt este evidențiat în contracția lantanidelor din perioada 6 a tabelului periodic. De la La la Hf există o contracție considerabilă a razei atomice ca rezultat al orbitalilor f, care se „umplu” pe măsură ce blocul f este traversat: cel al lantanoizilor și actinoizilor.
Un efect similar poate fi observat și cu elementele blocului p din perioada 4. De data aceasta, produsul efectului de protecție slab al orbitalilor d care se umplu atunci când trec prin perioadele metalice de tranziție..
Exemple
Pentru perioada 2 a tabelului periodic, razele atomice ale elementelor sale sunt:
-Li: 257 pm
-Fii: 112 pm
-B: 88 pm
-C: 77 pm
-N: 74 pm
-Sau: 66 pm
-F: 64 pm
Rețineți că litiul metalic are cea mai mare rază atomică (257 pm), în timp ce fluorul, situat la extrema dreaptă a perioadei, este cel mai mic dintre toate (64 pm). Raza atomică coboară de la stânga la dreapta în aceeași perioadă, iar valorile listate o arată.
Litiul, la formarea legăturilor metalice, raza sa este metalică; și fluor, deoarece formează legături covalente (F-F), raza sa este covalentă.
Ce se întâmplă dacă doriți să exprimați razele atomice în unități de angstrom? Pur și simplu împărțiți-le la 100: (257/100) = 2,57Å. Și așa mai departe cu restul valorilor.
Referințe
- Chimie 301. Raze atomice. Recuperat de la: ch301.cm.utexas.edu
- Fundația CK-12. (28 iunie 2016). Raza atomică. Recuperat de pe: chem.libretexts.org
- Tendințe în razele atomice. Preluat de la: intro.chem.okstate.edu
- Clackamas Community College. (2002). Dimensiunea atomică. Recuperat de la: dl.clackamas.edu
- Clark J. (august 2012). Raza atomică și ionică. Recuperat de pe: chemguide.co.uk
- Shiver & Atkins. (2008). Chimie anorganică. (Ediția a patra., Pp. 23, 24, 80, 169). Mc Graw Hill.


Nimeni nu a comentat acest articol încă.