
Regula lui Hund sau principiul multiplicității maxime
Regula lui Hund sau principiul multiplicității maxime stabilește, empiric, modul în care trebuie să ocupe electronii orbitali degenerați în energie. Această regulă, așa cum sugerează și numele său, a venit de la fizicianul german Friedrich Hund, în 1927, și de atunci a fost foarte utilă în chimia cuantică și spectroscopică..
Există într-adevăr trei reguli ale lui Hund aplicate în chimia cuantică; Cu toate acestea, primul este cel mai simplu pentru înțelegerea de bază a modului de structurare electronică a unui atom.
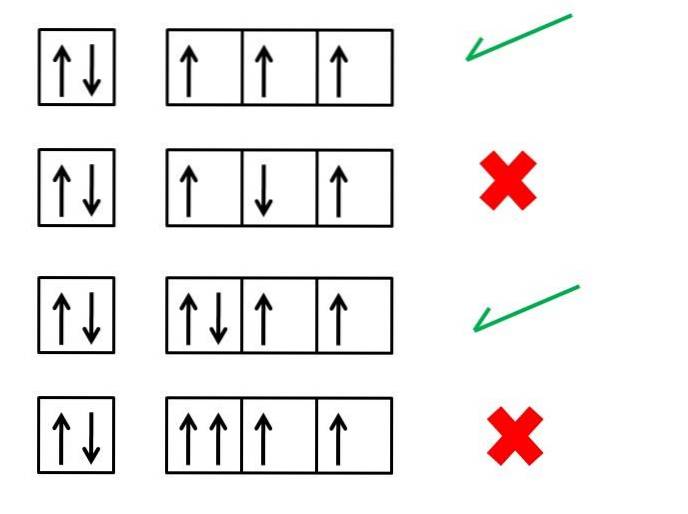
Prima regulă a lui Hund, cea a multiplicității maxime, este esențială pentru a înțelege configurațiile electronice ale elementelor; stabilește care ar trebui să fie ordonarea electronilor din orbitali pentru a genera un atom (ion sau moleculă) cu o stabilitate mai mare.
De exemplu, imaginea de mai sus prezintă patru serii de configurații de electroni; cutiile reprezintă orbitalii, iar săgețile negre reprezintă electronii.
Prima și a treia serie corespund unor moduri corecte de a ordona electronii, în timp ce a doua și a patra serie indică modul în care electronii nu ar trebui plasați pe orbitați.
Indice articol
- 1 Ordinea de umplere a orbitalilor conform regulii lui Hund
- 1.1 Împerecherea rotirilor
- 1.2 Rotiri paralele și antiparalele
- 2 Multiplicitate
- 3 Exerciții
- 3.1 Fluor
- 3.2 Titan
- 3.3 Fier
- 4 Referințe
Comandă de umplere orbitală conform regulii lui Hund
Deși nu se face nicio mențiune asupra celorlalte două reguli Hund, executarea corectă a ordinului de completare implică implicit aplicarea acestor trei reguli în același timp.
Ce au în comun prima și a treia serie de orbitali din imagine? De ce sunt corecte? Pentru început, fiecare orbital poate „adăposti” doar doi electroni, motiv pentru care prima casetă este completă. Prin urmare, umplerea trebuie să continue cu cele trei cutii sau orbitali din dreapta.
Împerecherea rotirii
Fiecare cutie din prima serie are o săgeată îndreptată în sus, care simbolizează trei electroni cu rotiri în aceeași direcție. Când arată în sus, înseamnă că rotirile lor au o valoare de +1/2 și, dacă arată în jos, rotirile lor vor avea valori de -1/2.
Rețineți că cei trei electroni ocupă orbitali diferiți, dar cu rotiri nepereche.
În cea de-a treia serie, al șaselea electron este situat cu un spin în direcția opusă, -1/2. Nu este cazul celei de-a patra serii, în care acest electron intră în orbital cu un spin de +1/2.
Și astfel, cei doi electroni, ca și cei din primul orbital, vor avea al lor rotiri împerecheate (unul cu rotire +1/2 și unul cu rotire -1/2).
A patra serie de cutii sau orbitali încalcă principiul excluderii Pauli, care afirmă că niciun electron nu poate avea aceleași patru numere cuantice. Regula lui Hund și principiul de excludere al lui Pauli merg întotdeauna mână în mână.
Prin urmare, săgețile trebuie așezate în așa fel încât să nu fie împerecheate până când ocupă toate cutiile; și imediat după aceea, acestea sunt completate cu săgețile îndreptate în direcția opusă.
Rotiri paralele și antiparalele
Nu este suficient ca electronii să aibă rotirile împerecheate: trebuie să fie, de asemenea, paralele. Acest lucru în reprezentarea cutiilor și săgeților este garantat prin plasarea acestora din urmă cu capetele lor paralele între ele..
A doua serie prezintă eroarea conform căreia electronul din a treia casetă își îndeplinește rotația într-un sens antiparalel față de ceilalți..
Astfel, se poate rezuma că starea de bază a unui atom este una care respectă regulile lui Hund și, prin urmare, are cea mai stabilă structură electronică.
Baza teoretică și experimentală afirmă că atunci când un atom are electroni cu un număr mai mare de rotiri nepereche și paralele, acesta se stabilizează ca urmare a creșterii interacțiunilor electrostatice dintre nucleu și electroni; creștere care se datorează scăderii efectului de protecție.
Multiplicitate
Cuvântul „multiplicitate” a fost menționat la început, dar ce înseamnă în acest context? Prima regulă a lui Hund stabilește că cea mai stabilă stare de bază pentru un atom este cea cu cel mai mare număr de multiplicitate de spin; cu alte cuvinte, cel cu orbitalii săi cu cel mai mare număr de electroni nepereche.
Formula pentru a calcula multiplicitatea spinului este
2S + 1
Unde S este egal cu numărul de electroni nepereche înmulțit cu 1/2. Astfel, având mai multe structuri electronice cu același număr de electroni, 2S + 1 poate fi estimat pentru fiecare și cel cu cea mai mare valoare a multiplicității va fi cel mai stabil..
Multiplicitatea de rotire poate fi calculată pentru prima serie de orbitali cu trei electroni cu rotirile lor fără egal și paralele:
S = 3 (1/2) = 3/2
Și multiplicitatea este atunci
2 (3/2) + 1 = 4
Aceasta este prima regulă a lui Hund. Cea mai stabilă configurație trebuie să respecte și alți parametri, dar care, în scopuri de înțelegere chimică, nu sunt pe deplin necesare..
Instruire
Fluor
Numai învelișul de valență este luat în considerare, deoarece se presupune că învelișul interior este deja umplut cu electroni. Configurația electronică a fluorului este, prin urmare, [He] 2sDouă2 P5.
Un orbital 2s trebuie umplut mai întâi și apoi trei orbitali p. Pentru a umple orbitalul 2s cu cei doi electroni, este suficient să le așezați în așa fel încât rotirile lor să fie împerecheate.
Ceilalți cinci electroni pentru cei trei orbitali 2p sunt aranjați așa cum este ilustrat mai jos.
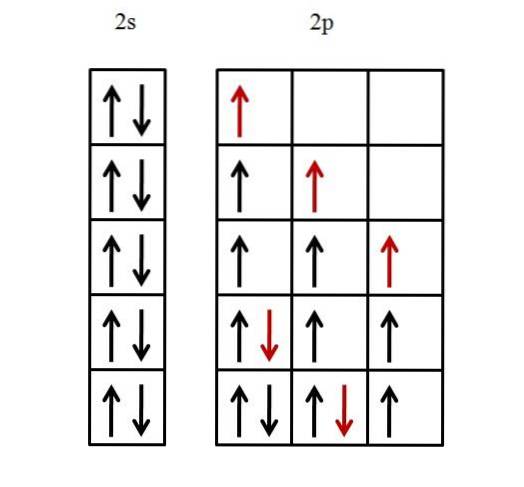
Săgeata roșie reprezintă ultimul electron care umple orbitalii. Rețineți că primii trei electroni care intră pe orbitalii 2p sunt plasați nepereche și cu rotirile lor paralele.
Apoi, de la cel de-al patrulea electron, începe să-și împerecheze spinul -1/2 cu celălalt electron. Al cincilea și ultimul electron decurge în același mod.
Titan
Configurația electronică a titanului este [Ar] 3dDouă4sDouă. Deoarece există cinci d orbitali, se recomandă să începeți pe partea stângă:
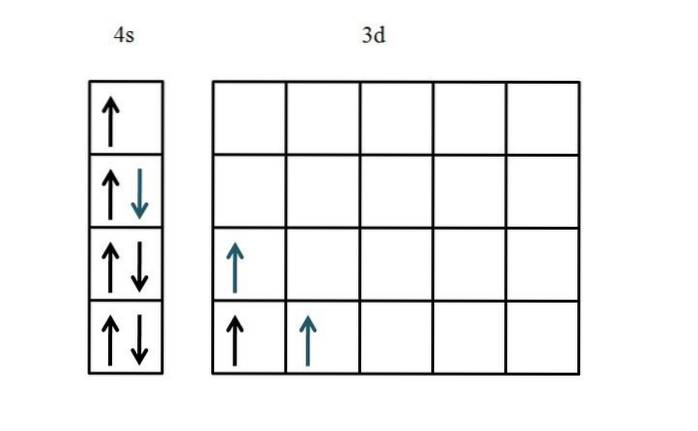
De data aceasta s-a arătat umplerea orbitalului 4s. Deoarece există doar doi electroni în orbitalele 3D, nu există aproape nicio problemă sau confuzie atunci când le plasăm cu rotirile lor nepereche și paralele (săgeți albastre).
Fier
Un alt exemplu, și în cele din urmă, este fierul, un metal care are mai mulți electroni în orbitalele sale decât titanul. Configurația sa de electroni este [Ar] 3d64sDouă.
Dacă nu ar fi regula lui Hund și principiul excluziunii Pauli, nu am ști cum să aranjăm astfel de șase electroni în cei cinci orbitalii lor..
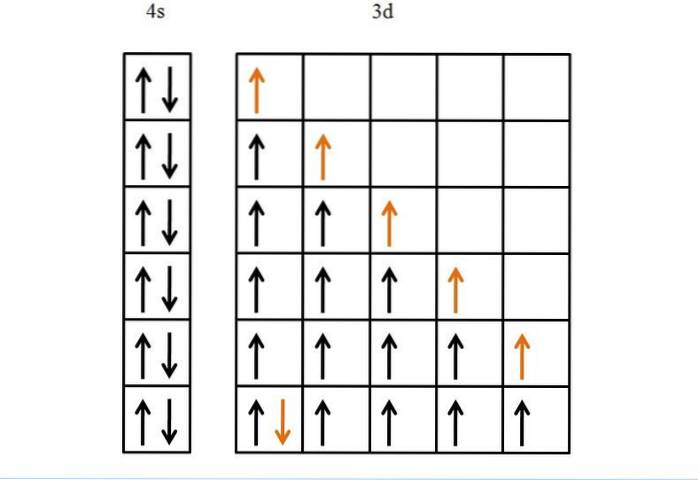
Deși poate părea ușor, fără aceste reguli ar putea apărea multe posibilități greșite în ceea ce privește ordinea de umplere a orbitalilor.
Datorită acestora, avansul săgeții de aur este logic și monoton, ceea ce nu este altceva decât ultimul electron plasat în orbital..
Referințe
- Serway & Jewett. (2009). Fizică: pentru știință și inginerie cu Fizică modernă. Volumul 2. (ediția a șaptea). Cengage Learning.
- Glasstone. (1970). Manual de chimie fizică. În Cinetica chimică. A doua editie. D. Van Nostrand, Company, Inc..
- Méndez A. (21 martie 2012). Regula lui Hund. Recuperat de pe: quimica.laguia2000.com
- Wikipedia. (2018). Regula lui Hund de multiplicitate maximă. Recuperat de pe: en.wikipedia.org
- Chimie LibreTexte. (23 august 2017). Regulile lui Hund. Recuperat de pe: chem.libretexts.org
- Nave R. (2016). Regulile lui Hund. Recuperat de la: hyperphysics.phy-astr.gsu.edu



Nimeni nu a comentat acest articol încă.